バーテックス・ファーマシューティカルズ(VRTX)2022年第3四半期決算説明会の日本語訳です。
好決算で株価も急伸ですね。株価は前回の高値をブレイクアウトしたので買い時かもしれません。
製品自体も競争力があり魅力的なので買っていきたいですね。
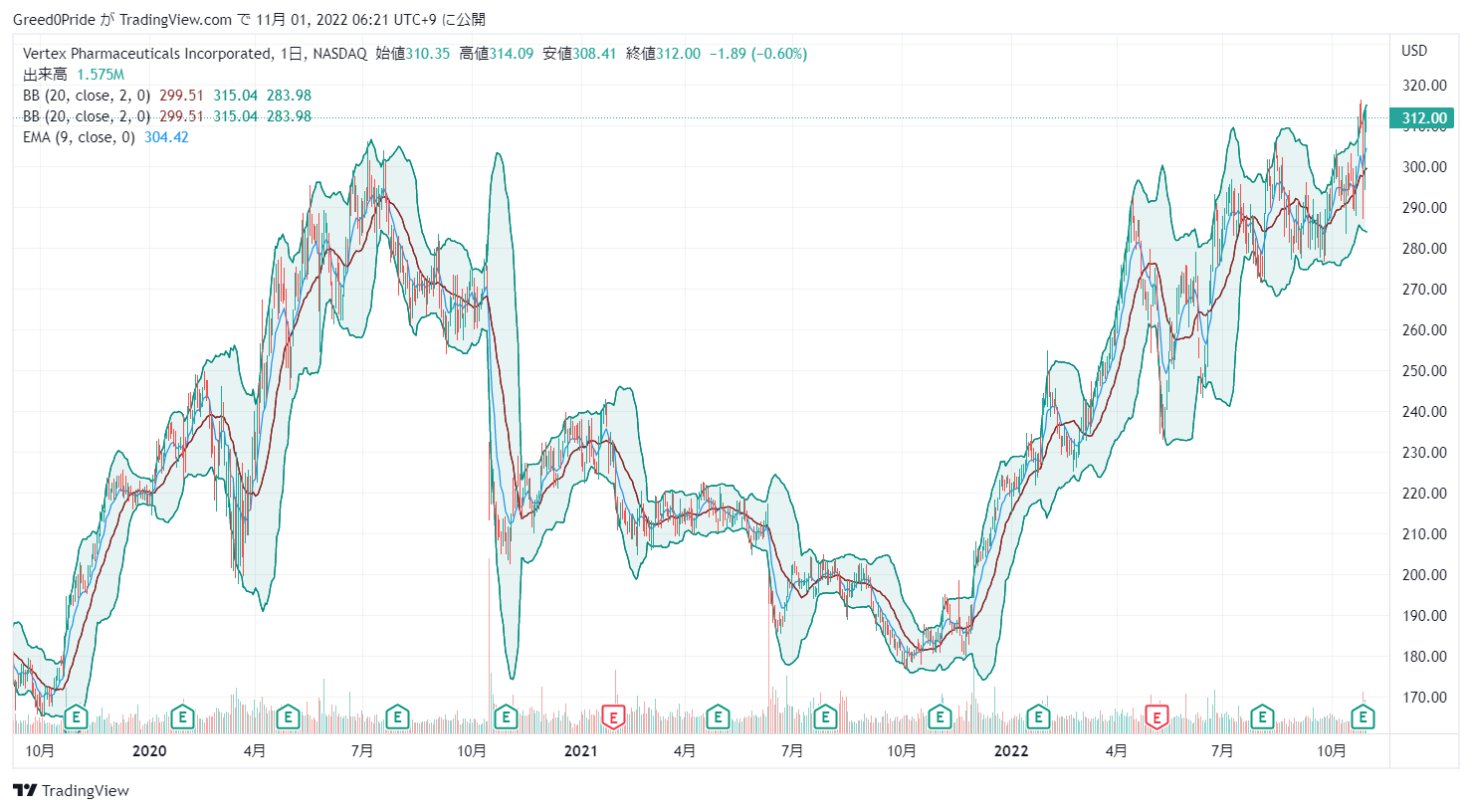
バーテックス・ファーマシューティカルズ(VRTX)株価
前回の2022年第2四半期決算説明会はこちらです。
バーテックス・ファーマシューティカルズ(VRTX)2022年第3四半期決算説明会
Call participants:
Susie Lisa — Senior Vice President of Investor Relations
Reshma Kewalramani — Chief Executive Officer and President
Stuart Arbuckle — Chief Operating Officer
Charlie Wagner — Chief Financial Officer
Unknown speaker
Mohit Bansal — Wells Fargo Securities — Analyst
Salveen Richter — Goldman Sachs — Analyst
Phil Nadeau — Cowen and Company — Analyst
Evan Seigerman — BMO Capital Markets — Analyst
David Risinger — SVB Securities LLC — Analyst
Kripa Devarakonda — Truist Securities — Analyst
Jessica Fye — J.P. Morgan — Analyst
More VRTX analysis
2022年10月27日午後4時30分(米国東部時間)
オペレーター
バーテックス・ファーマシューティカルズ 2022 年第 3 四半期決算説明会にようこそ。参加者の皆様は、リスニングオンリーモードとなります。[本日のプレゼンテーションの後、質問の機会を設けています。[このイベントは録音されています。
それでは、スージーリザさんに会見を引き継ぎたいと思います。どうぞよろしくお願いします。
スージーリザ — インベスターリレーションズ担当上級副社長
皆さん、こんばんは。私はスージーリサと申します。2022年第3四半期決算の電話会議にようこそ。今夜の電話では、準備のため、Reshma Kewalramani博士にご挨拶をお願いしています。
Reshma Kewalramani(バーテックス社CEO兼社長)、Stuart Arbuckle(最高執行責任者)、Charlie Wagner(最高財務責任者)です。この電話会議をお聞きになる際には、ウェブキャストのスライドにアクセスされることをお勧めします。本通話は録音されており、再生は当社ウェブサイトにてご覧いただけます。この電話会議では、本日のプレスリリースおよび米国証券取引委員会に提出した書類に詳述されているリスクや不確実性を前提とした、将来の見通しに関する記述を行う予定です。
これらの記述は、バーテックスが販売する嚢胞性線維症治療薬、当社のパイプラインおよびバーテックスの将来の財務実績に関するものを含むがこれに限定されず、経営陣の現在の仮定に基づくものである。実際の結果や事象は、大きく異なる可能性があります。また、今晩の電話会議で検討する一部の財務結果およびガイダンスは、非GAAPベースで表示されていることに留意してください。それでは、Reshmaに電話をつなぎます。
レシュマ・ケワラマニ — 最高経営責任者兼社長
ありがとう、スージー。お招きいただき、うれしく思います。本日はお電話にご参加いただきありがとうございます。1)嚢胞性線維症のすべての患者さんに製品をお届けし、持続可能な力強い成長を実現する、2)多様な中・後期臨床パイプラインを前進させ、複数の疾患領域で革新的な医薬品を開発する、3)次の商業上市の準備を進める、4)臨床に向けて次のイノベーションの波を進展させる、という目標に向けて極めて優れた業績を上げ、大きな前進を続けているバーテックス社です。
第3四半期の世界のCF製品の売上高は、当社のCFTRモジュレーターによる治療を開始する患者さんが増えたことにより、前年同期比18%増の23億ドルとなりました。この好調な業績を踏まえ、2022年通年の製品売上高ガイダンスを86億ドルから88億ドルに引き上げ、88億ドルから89億ドルにすることにしました。CFTRモジュレーターを使用するCF患者の数は増加していますが、到達すべき患者数はまだ多くあります。そして、スチュアートからの報告にあるように、私たちは、私たちの治療法の恩恵を受ける可能性のある世界中のすべての患者さんに届けるために、集中力と緊急性をもって取り組んでいます。
先に述べたように、私たちは今、会社にとって重要な転換期にあります。当社の臨床段階のプログラム、鎌状赤血球症とベータサラセミア、急性痛、AMKD、1型糖尿病、AATDは、いずれもファーストインクラスまたはベストインクラスのアプローチで、病気を変える可能性があり、それぞれが数十億ドルのビジネスチャンスを意味するものです。バーテックスは、他に類を見ない強固で耐久性のあるCFフランチャイズ、短期間で商業化の可能性がある複数の広範で深い研究開発パイプライン、強固なバランスシート、社内外のイノベーションと優秀な人材への投資能力により、今後数年間にわたって患者さんと株主の皆様に貢献できる立場にあると言えます。この概要を踏まえて、CFから始めて最近の研究開発の進捗の詳細に移ります。
TRIKAFTAは、登録試験だけでなく、実臨床試験や長期試験においても、安全性と有効性の面で非常に高いハードルを設定しています。とはいえ、CF患者さんにとってさらに有効な医薬品を開発することが可能であれば、私たちはそのような企業になることを決意しています。VX-121/テザカフター/VX-561は、その可能性を秘めたネクストインクラスの3剤併用療法です。現在、vanzacaftor、tezacaftor、deutivacaftorまたはvanzacaftor tripleと呼ばれるこの3剤併用療法は、12歳以上の患者さんを対象とした第3相試験で急速に進展しており、本年中に登録が完了すると予想されています。
この組み合わせは、当社のヒト気管支上皮試験において、TRIKAFTAよりも高い活性を示し、第2相試験において、当社のどの先行医薬品よりも高い臨床的有用性が確認されました。さらに、1日1回の投与という利便性もあり、ロイヤリティもTRIKAFTAの2桁台後半に対して1桁台前半となります。CFTRタンパク質を全く作らない5,000人の患者さんに対しては、Modernaのパートナーと共同でmRNA療法に取り組んでいます。このプログラムについては、IND取得に向けた試験を完了し、今四半期中のIND提出とその後の臨床試験開始に向けて順調に進んでいますが、まだ終わりではありません。
私たちは、より多くのCF患者さんを汗の塩化物キャリアレベルにまで引き上げることができるよう、さらに優れた治療法の可能性を見出すための研究を続けています。エクサセル(旧CTX001)については、重症鎌状赤血球症と輸血依存性βサラセミア(TDT)に対する当社の遺伝子編集プログラムです。これはCF以外では最も進んだプログラムであり、エクサセルが次の商業的な上市につながると期待しています。6月には、エクサセルの主要臨床試験で得られた75名の患者さんの37カ月に及ぶ追跡調査データを発表しました。
このデータにより、エクサセルがこれらの患者さんに1回限りの機能的治癒を提供する可能性が示されました。先月、当社は、米国で利用可能なほぼすべての薬事指定を受けたことに加え、FDAがエクサセルのローリングレビューを承認したことを発表しました。当社は、米国において、鎌状赤血球症とβサラセミア症の両方のBLA申請を来月から開始する予定です。
来月には鎌状赤血球症とβサラセミア症の申請を開始し、2023年の第1四半期末までに申請を完了させる予定です。欧州では、EUのEMEAおよび英国のMHRAとそれぞれ申請パッケージについて合意に至ったことを以前お伝えしました。これらの MAA を年内に提出する予定であることに変わりはありません。当社のチームは、患者さんに一刻も早く「exa-cel」をお届けするために、3つの規制当局に提出する複雑な複数の申請書類の準備に集中的に取り組んでいます。
そのため、ASHでは新しい臨床データを発表せず、2023年の前半に最新の臨床データを発表する予定です。エクサセルは、重症鎌状赤血球症および輸血依存性βサラセミアの数千人の患者さんにとって、一度で治る治療法として期待されています。この治療法は、CRISPRを用いた遺伝子編集治療法として初めて、遺伝性疾患の患者さん向けに商業化される可能性があり、近い将来、大きな市場機会をもたらすものと考えています。VX-548と当社の疼痛プログラムについて説明します。
VX-548は、新規の選択的NaV1.8阻害剤であり、オピオイドのような副作用や習慣性の可能性を伴わない、非常に効果的な疼痛緩和の可能性を提供するものです。NaV1.8は、遺伝学的および薬理学的に検証されたターゲットです。VX-150は、初期のNaV1.8阻害剤であり、急性神経障害性疼痛および筋骨格系疼痛において良好な概念実証がなされたことを想起してください。VX-548は、2つの第2相プラセボ対照急性疼痛試験において、プラセボと比較して統計的に有意かつ臨床的に意味のある疼痛緩和を示し、全般的に良好な忍容性が確認されました。
また、本試験では、VX-548の評価をサポートするためにオピオイド参照群が含まれています。VX-548は、米国においてファスト・トラックおよびブレークスルー・セラピーに指定されており、中等度から重度の急性痛に対する幅広い適応をサポートする第3相プログラムのデザインについてFDAと合意に達し、最近、主要な試験を開始しました。VX-548の急性痛を対象としたフェーズ3開発計画は、2つの無作為化比較試験で構成されています。
RCTのデザインは、第2相試験と非常によく似ており、同じ疼痛状態、外反母趾手術後と腹部整形手術後です。治療期間も48時間と同じで、主要評価項目もVX-548とプラセボの48時間における疼痛強度差の合計(SPID)です。第3の単群試験は、第3相プログラムを締めくくるものです。この試験では、中等度から重度の急性痛を有する他の複数のタイプの患者さんを登録し、治療期間は最長14日間とする予定です。
当社は、この種の試験を効率的に実施した経験、短い治療期間、およびオピオイドの重大な副作用や中毒の可能性を伴わない効果的な鎮痛に対する高いアンメットニーズを考慮し、VX-548は近い将来に大きな市場機会があると見なしています。また、VX-548は神経障害性疼痛を対象とした試験も計画しており、痛みを伴う糖尿病性神経障害の患者を対象とした第2相用量設定試験も今年末に開始する予定です。VX-147は、APOL1を介した腎疾患の根本的な原因を治療する最初の医薬品となります。イナキシプリンは、米国でブレークスルー・セラピー(画期的治療法)の指定を受けています。
また、欧州ではプライムドラッグとオーファンドラッグの両方の指定を受けています。Inaxaplinは、単一適応の無作為化二重盲検プラセボ対照第2/3相ピボタル試験で、主要評価項目は、標準治療に追加してInaxaplinを投与した患者さんの腎機能低下率を標準治療と比較して約2年間減少させることです。重要なことは、本試験は治療開始48週目にあらかじめ中間解析が行われており、これが良好であれば、米国での迅速承認の根拠となり得るということです。本試験では、患者さんの登録が進行中です。
現在、米国および海外で50施設以上が登録のためにオープンしており、合計150施設以上のオープンを目指しています。試験の進展に伴い、登録状況や試験の進捗状況をお知らせすることを楽しみにしています。次に、1型糖尿病についてです。
私たちは、3つのプログラムを進めています。まず、VX-880は、幹細胞由来の完全分化型インスリン産生膵島細胞補充療法で、臨床開発の中盤にあります。このプログラムでは、標準的な免疫抑制療法を用いて、細胞を免疫システムから保護します。この同じ細胞が、1型糖尿病に関する他の2つのプログラムの基礎となっています。
次に、細胞プラスデバイスプログラムです。この完全に分化した膵島細胞を独自のデバイスに封じ込め、細胞を体の免疫システムから保護し、免疫抑制剤を必要としません。このプログラムについては、年内のIND申請に向けて順調に進んでいます。最後に、前臨床開発中の低免疫細胞プログラムでは、同じように完全に分化したインスリン産生膵島細胞を編集して免疫系から遮断し、免疫抑制剤の必要性をなくすことを試みています。本年初めには、VX-880の1型糖尿病におけるProof of Conceptを達成し、試験パートAにおいて最初の2人の患者に半量を投与することができました。
現在、目標用量をすべて投与するパートB試験が進行中であり、患者さんの登録が行われています。1型糖尿病プログラムは大きな可能性を秘めています。低血糖の心配がなく、インスリンを必要としないグルコースコントロールが期待できる治療法の恩恵を受ける1型糖尿病の患者さんは、米国とEUだけで250万人以上います。
より多くの患者さん、より長い期間の追跡調査から得られた追加データを、適切な時期に共有できることを期待しています。最後に、当社の1型糖尿病プログラムについてお話します。最近、Viacyte社の買収を完了しましたので、Viacyte社の社員を温かく迎えたいと思います。最後に、当社のα1アンチトリプシン欠損症(AATD)プログラムについてお話します。
今月初めには、次世代AAT補正薬の第一弾であるVX-634のINDがクリアとなり、VX-634がヒト初臨床試験を開始したことを発表しました。また、当社の第一世代AAT補正薬であるVX-864の48週間第2相臨床試験を間もなく開始することを発表しました。この試験では、長期投与による肝臓からのポリマーのクリアランス、および機能性AATの血清レベルへの影響を評価する予定です。以上の研究開発のハイライトを踏まえて、商業的な進捗状況についてスチュアートに話を譲ろう。
スチュアート・アーバックル — 最高執行責任者
ありがとう、リシュマ。今夜は、CFの好調を維持し、また、CFにおける強い見通し、exa-celの商業的発売準備の大きな進展、疼痛治療におけるVX-548の有望な役割に関する我々の見解など、我々の事業全体で見られる複数の短期商業機会についてレビューできることを嬉しく思います。まずCFからです。米国では、当社の治療薬に見られる非常に高い持続性とコンプライアンスを維持し、治療の効果をより若い年齢層まで拡大することに重点を置いています。
米国外では、償還協定が結ばれた国々でKAFTRIO/TRIKAFTAの普及が進み、急成長を遂げています。また、6歳から11歳の小児におけるKAFTRIOの使用も、この適応症が保険償還された国々で好調に推移しています。現在、当社の医薬品は30カ国以上で承認・償還されており、5大陸で何万人もの嚢胞性線維症の患者さんの役に立っています。しかし、まだ治療を受けていない数千人のCF患者さんがいます。
これらの患者さんは、主に次のカテゴリーに分類されます。1つは、最近償還合意や若年層の患者さんへのラベル延長を達成した国など、当社が発売曲線の早い段階にある患者さん、2つは、ラベルや償還の延長を引き続き追求している若年層の患者さん、3つは、ごく少数の国で当社の医薬品が償還されるのを待っている患者さん、などです。これらの患者さんの大部分にはいずれ到達できると確信しており、それが短期的にも長期的にも継続的な収益成長の原動力になると考えています。また、当社のCFTRモジュレーターの適応症の若年層への拡大についても、引き続き素晴らしい成果を上げています。9月には、ORKAMBIが米国で生後12カ月から24カ月未満の小児に対する承認を取得しました。
KALYDECOについては、2022年末までに、生後1カ月から4カ月未満の小児を対象に米国FDAに承認申請する予定です。同様に、TRIKAFTAについても、2歳以上5歳未満の小児を対象に年内に米国をはじめとする世界の規制当局に承認申請を行う予定です。
最後に、CFについては、Reshmaが述べたように、当社のCFTR mRNAプログラムは、今年のIND申請に向けて進行しています。このプログラムは、全世界で約5,000人のCF患者さんの疾患の根本的な原因をターゲットにしています。CF以外にも、当社は幅広く、多様で、高度な研究開発パイプラインを有しています。私は、当社の商業的準備の取り組みと、次に発売される可能性のある製品、エキサセルとVX-548の市場機会に焦点を絞ってコメントします。
エクサセルは、鎌状赤血球症および輸血依存性βサラセミアの患者さんを治癒する可能性があり、当社は発売準備活動を大きく前進させています。エクサセルによる治療は、開始から終了まで数カ月を要するプロセスであり、このような新規で治癒の可能性のある治療法を患者さんに提供することは大きな機会と課題の両方があることを十分に認識しています。私たちは、医師と患者さんのために必要なインフラとサポートを構築しており、規制当局の承認が得られれば商業的な成功につながると考えています。当社のコマーシャルチームとメディカルサイエンスリエゾン(MSC)のフィールドチームは、米国で雇用され、トレーニングを受けています。
これらのチームは、主要な治療施設、政策立案者、支払者に積極的に働きかけ、欧州でも同様の取り組みが進行中です。エクサセルの最初の上市は、米国および欧州の重症鎌状赤血球症およびβサラセミアの患者さん約32,000人に焦点を当てる予定です。この32,000人の患者さんのうち、約25,000人が重症鎌状赤血球症の患者さんで、その大部分が米国に居住しています。
これらの患者さんは、特定の地域に非常に集中しています。そのため、米国では約50カ所、欧州では約25カ所の認定治療施設のネットワークにより、効果的に患者さんに対応することができると考えています。ちなみに、米国では、約250のCF治療施設に声をかけることで、大多数のCF患者さんにリーチすることができました。
米国では、約250のCF治療センターと連携することで、CF患者の大半にリーチすることができました。これらの施設は、将来的なエクサセルの使用をサポートするための医療的・技術的専門知識を有しています。当社の現場チームは、必要な管理・物流能力、発売をサポートするための治療能力について、すでにこれらのセンターと連携しています。センターとそのスタッフからの早い段階での関心と取り組みに、私たちは勇気づけられています。
これらの治療センターとの協力と並行して、私たちは政策立案者や支払者と緊密に連携し、これらの関係者がこれらの疾患の大きな負担を理解できるように努めています。エクサセルのような一回で治る可能性のある治療法が患者さんと医療制度にもたらす価値を考えると、支払いモデルは重要な検討課題です。私たちは、エクサセルの適応となる可能性のある患者さんが、この根治療法にアクセスできるよう、様々な関係者と引き続き協力していきます。痛みに目を向けると
VX-548は、急性痛、神経障害性痛、筋骨格系痛など、あらゆる痛みに対して重要な役割を果たす可能性があると信じています。最近、VX-548の第3相臨床試験が開始され、これらの試験における治療期間が短いことから、急性痛は現在、短期的な商業的機会として有望な可能性を秘めています。私は、Vertexが急性痛の市場を形成する上で重要な3つのポイントに焦点をあてて発言します。1つは、その機会が大きいということです。
2つ目は、処方が病院に集中しているため、バーテックスのモデルに合った専門的な商業インフラで対応できることです。3つ目は、医師と患者にとって安全で効果的な治療オプションの市場には大きなギャップがあることです。第一に、ジェネリック医薬品の普及率が90%であるにもかかわらず、米国市場は約40億ドルであり、急性痛の経口治療で年間約15億日の患者さんが受診しています。この新しいクラスの医薬品は非常に有効で忍容性が高く、したがって数十億ドルの可能性を秘めています。また、これらの治療日数の約3分の2にあたる10億ドルは、手術や緊急外来受診などの入院・外来処置に伴う病院での処方に起因しています。
これには、患者さんの入院中に書かれ充填される処方箋や、継続的な疼痛管理のために患者さんに数日間の投薬コースを提供するために退院時に書かれる処方箋が含まれます。病院での処方によって疼痛治療が集中していることを考えると、専門的な営業とマーケティングのインフラがあれば、この市場の多くの割合にリーチできると考えています。そして、この市場の3つ目の重要な考慮点は、オピオイド治療による重大な副作用です。米国では、オピオイドによる過剰摂取による死亡者数が増え続けています。
また、急性痛の治療を目的としたオピオイドの処方が、オピオイドの蔓延の一因であることは明らかです。これに対し、全米の病院、医師、州機関は、急性痛の治療に対するオピオイドの使用を制限したり、削減を試みている。多くの州や、Kaiser PermanenteやJohn Hopkins Medicineなどの大規模な病院システムは、オピオイドの処方を減らすために厳しい措置を取っています。
さらに、オピオイドには中毒性以外にも、吐き気、傾眠、便秘などの悪い副作用があり、これらの問題が解決されるまで入院期間が長くなる可能性があります。このように、オピオイドには、医師や患者にとって安全で効果的な治療法の選択肢がないため、急性痛の治療市場には大きなギャップがあります。したがって、VX-548のように、オピオイドのような依存性や重大な副作用を持たない、新規で非常に有効な非オピオイド治療薬が利用できれば、非常に貴重な新しい治療オプションとなり、処方されたNSAIDsに続く治療戦略として使用でき、オピオイドは最後の手段としてのみ使用されることになるでしょう。今後、神経因性疼痛における機会についての見解を含め、疼痛に関する当社の商業化計画について、さらに詳しくお知らせすることを楽しみにしています。
最後に、当社のCF治療薬の有用性を世界中のより多くの患者さんに知っていただく機会であり、CF以外の重篤な疾患の患者さんに対しても複数の革新的な治療薬を商業化する近い将来の可能性に、私は大きな期待を持っています。それでは、チャーリーから財務の説明をしていただきます。
チャーリー・ワグナー — 最高財務責任者
ありがとうございます、スチュアート。バーテックスの2022年第3四半期および累計業績は、今年も卓越した財務実績と強力な実行力を発揮するペースにあります。2022年第3四半期の売上は前年同期比18%増の23億ドルで、最近償還が実現した市場でのTRIKAFTA/KAFTRIOの継続的な好調と、若年層へのラベル拡張による米国外の46%増に牽引されています。
米国におけるCFの売上は、若年層への浸透により、引き続き安定した業績で5%増となりました。当四半期、CF の売上増加には、特定市場におけるチャネル在庫の約 7,500 万ドル増加も寄与しました。第4四半期においては、これらの購入が繰り返されることはないと見込んでおり、この四半期ごとの段階的 な増加は、通期ガイダンスの更新にも反映されています。
2022年第3四半期の非GAAPベースの研究開発費、買収した知的財産の研究開発費および販売管理費の合計は7億5,800万ドルで、2021年第3四半期と比較して29%増加しました。2022年を通じて、当社は研究開発パイプラインへの投資を継続し、現在7つのプログラムを有し、そのうち5つは極めて重要な開発段階にあります。第3四半期の前年同期比の増加は、これらのプログラムへの投資の強化、特に疼痛、mRNAとCFおよび1型糖尿病における新しいバンザカフトールのトリプル、およびエクサセルの商業化前のビルドアウト活動の継続を反映しています。今後も、研究および臨床段階のパイプラインへの投資を継続するとともに、疼痛治療薬exa-celやVX-548など、近い将来に大きな商業的可能性を秘めたプログラムの商業的準備活動にも投資していく予定です。
また、当社の研究開発戦略に沿った外部のイノベーションにより、社内の研究努力を補強することに引き続き尽力していきます。2022年第3四半期のnon-GAAPベースの営業利益率は55%でした。当四半期の非GAAPベースの営業利益は13億ドルで、前年同期比11%増となりました。2022 年第 3 四半期の非 GAAP 方式の実効税率は 21%でした。
キャッシュフロー創出とバランスシートが非常に堅調であることから、当四半期は98億ドルの現金及び投資で終了しました。事業開発面では、先に発表したViaCyte社の買収を現金3億2,000万ドルで完了し、統合活動が進行中です。次に、ガイダンスに切り替えます。2022年のCF製品売上ガイダンスを中間値で1億5,000万ドル増やし、新たに88億ドルから89億ドルの範囲に設定します。
この増額には、最近保険償還の合意がなされた市場でのTRIKAFTA/KAFTRIOの好調な取り込みと、米国での継続的な業績が反映されています。中間値での増額は、2022年通年の収益が2021年比で約17%増加することになり、バーテックスにとって8年連続で2桁の収益増となる予定です。2022年の非GAAPベースの研究開発費、買収した知的財産の研究開発費、販売管理費の合計額30億ドルから31億ドルという予測に変更はありません。また、通期のnon-GAAPベースの実効税率ガイダンスの範囲である21%から22%に変更はありません。
最後に、為替の動向についてコメントします。年初来のユーロなどに対する大幅なドル高の影響は、当社の為替リスク管理プログラムにより一部緩和されています。2022年通年では、現在のレートでは、プログラム効果控除後の外国為替の変動が当社の収益成長に約1%のマイナスの影響を与えると推定され、これは通年の収益ガイダンスの更新範囲に反映されています。
最後に、バーテックスは、厳しいマクロ経済情勢にもかかわらず、非常に好調に推移しています。2022年の残り期間と2023年に向けて、このスライドで強調したように、私たちの継続的な進歩を示すさらなる重要なマイルストーンを楽しみにしています。Reshmaが述べたように、過去1年間、バーテックスは研究開発パイプラインを大幅に加速させ、会社の多様化と長期的な成長プロファイルの追加に向け順調に進んでいます。いつものように、今後の電話会議で進捗状況をご報告できることを楽しみにしています。
それでは、スージーに電話を戻し、質疑応答を始めたいと思います。
スージー リサ — インベスターリレーションズ担当上級副社長
ありがとう、チャーリー。チャック、質問を始めてください。
質疑応答
オペレーター
はい、奥様。これより質疑応答を開始します。[まず最初の質問は ジェフリーズの マイケル・イーです 最初の質問は ジェフリーズの マイケル・イーです
どうぞ
スピーカー不明
こんにちは、マイクに代わってデニスです。今期の進捗状況についておめでとうございます。現在進行中の糖尿病治療薬のフェーズ1、VX-880の状況について教えてください。また、今年中に最新のデータが得られるのでしょうか?また、その時期について教えてください。
また、デバイスプログラムについては、2023年に初期データを見ることができるものでしょうか?また、VX-880のベータ版が1患者分しか開示されていないことから、そのプログラムのデータ開示レベルについてどのように考えるべきでしょうか?ありがとうございました。
Reshma Kewalramani — 最高経営責任者兼社長
どうもありがとうございました。ご質問は、当社の1型糖尿病プログラムについてです。1型糖尿病のポートフォリオには、実は3つのプログラムがあります。1つ目はVX-880で、こちらは実際に第1/2相の段階にあります。
これはすでに患者さんがいるプログラムです。このプログラムでは、最初の2人の患者さんを治療し、重要なことに目標量の半分の用量で、すでに概念実証を達成しました。このプログラムは現在も継続中です。現在、患者さんを登録し、目標用量を投与しており、来年には適切な会議や会場でデータを共有できると考えています。
このポートフォリオの2つ目のプログラムは、細胞+デバイスプログラムです。このプログラムでは、INDが今年後半に予定されています。データ開示の面で何を期待すべきか、いつデータを見ることができるかということですが、私は1型糖尿病プログラムについて、細胞単独か細胞+デバイスかにかかわらず、CTX001に近く、低分子プログラムにはあまり似ていないと考えています。つまり、1回で治る可能性のある治療を患者さんに行うので、患者さんの数が少なくても、治療効果や新しいプロファイルについて多くのことを知ることができるのです。
ですから、いつデータが出るかについて正確にコメントするには少し早すぎますが、このプログラムは低分子化合物よりもCTXに近いと考えています。最後に、1型糖尿病プログラムをまとめると、このプログラムの第3の柱は、同じエクサセル、つまり臨床ですでに効果を実証しているVX-880細胞で、その細胞を編集して、免疫系から遮断し、免疫抑制剤を使わなくてもよいようにすることです。
スージーリザ — 投資家向け広報担当上級副社長
次の質問、チャックさんお願いします。
オペレーター
次の質問は、ウェルズ・ファーゴのモヒット・バンサルからです。どうぞよろしくお願いします。
Mohit Bansal — Wells Fargo Securities — アナリスト
素晴らしい。私の質問を聞いてくださってありがとうございます。また、私の方からもスージーリザを歓迎します。この増強剤と補正剤で最大限の効果を引き出すことができるのか、FEVの効果について1つだけ質問させてください。ある専門家が、TRIKAFTAの改善率が14%であれば、高い方で、あと3、4%で、この種の治療で達成できる最大のプラトーに達するだろうと述べていました。
次世代コンボがそこに到達したと仮定して、この種の治療で達成できる最大値はおそらくこれだろうという意見に同意されますか?ありがとうございました。
Reshma Kewalramani — 最高経営責任者兼社長
Mohitさん、どうもありがとうございます。ご質問は、CFTRモジュレーター全般についてでしょうか?また、利益という点では何が期待できるのでしょうか?その質問をもう少し吹き出して広げてみます。CFTRモジュレーターの有用性について考えるとき、CFは病気として、全身性の病気であることを認識することが重要です。
つまり、唯一の症状は肺ではないのです。肺は非常に目立つ症状ですが、それだけが症状ではありません。では、どういうことかというと CFの患者さんは、肝臓疾患にも難があります。内分泌や外分泌の膵臓疾患にも難がありますし、CFTRモジュレーターがない場合、体重や身長を増やし、質の高い生活を送ることが難しいことはご存知の通りです。
CFTRモジュレーターの本当の利点は、カリーデコから始まり、トリカフタに至るまで、肺機能の改善であることが分かっています。そして、それを測定するのがppFEV1です。TRIKAFTAで達成した14%は最大値なのでしょうか。ppFEV1の効果が最大になるかどうかは、まだ判断がつかないと思います。しかし、次のインクラスの組み合わせは、VX-121、テザカフトール、561の組み合わせです。
第2相試験では、最大で20%のベネフィットを得ることができる集団が検索されました。ですから、審査はまだ終わっていないと思いますし、次の分子にも期待しています。NACFCでは、TRIKAFTAやその他のCFTRモジュレーターのデータを含むいくつかの演題が発表されます。ppFEV1に対する効果が、死亡率、肺移植、入院、肺増悪の面でも有効であることがわかり、本当に心強く思っています。
ありがとうございました。
スージー リサ — 投資家向け広報担当上級副社長
次の質問、チャックさんお願いします。
オペレーター
次の質問は、ゴールドマン・サックスのサルヴィーン・リクターからです。どうぞよろしくお願いします。
サルヴィーン・リヒター — ゴールドマン・サックス — アナリスト
こんにちは。私の質問に答えてくれてありがとうございます。私からは2つだけです。1つは、1型糖尿病プログラムについてです。
免疫システムから細胞を完全に保護すると同時に、デバイスの中で細胞の完全性を維持する方法について教えてください。次に、100億ドルの現金をお持ちですね。もし、価値を創造するような事業開発を行わないのであれば、自社株買いや配当金で還元することを期待すべきでしょうか。ありがとうございました。
レスマ・ケワラマニ(Reshma Kewalramani) — 最高経営責任者兼社長
サルヴィーン、ありがとうございます。まず1型糖尿病について、そして資本配分の質問ですが、詳細はチャーリーにお願いしたいと思います。1型糖尿病プログラムおよび細胞+デバイスの組み合わせについては、私たちは長い間懸命に取り組んできましたし、買収以前からこれに取り組んできたセンマのチームにも感謝しています。1つは、細胞に十分な酸素と栄養を与えること、2つは、異物反応を防ぐこと、3つは、栄養と酸素は入るが免疫細胞は入らないように細胞を保護し、グルコースの感知とインスリンの放出が確実に行われるようにすることです。
VX-880で使用する独自のデバイスは、細胞を保護しつつ、栄養と酸素の流れを確保するという、これらの問題を考慮し、対処するための機能を備えています。2つ目は、大動物実験も含めたすべての前臨床試験で、異物反応が見られないことです。そして3つ目は、グルコースを感知してインスリンを放出する能力を持つことです。サルヴィーン、1型糖尿病プログラムの最も困難な部分は、実際に完全に分化したインスリン産生細胞を持っていることだ、と申し上げておきます。
この部分については、半量で治療した最初の2人の患者さんで概念実証が達成されたので、もう大丈夫だと考えています。資本配分の質問ですが、資本に関する私たちの戦略は変わっていません。焦点は、社内外のイノベーションにあります。チャーリー、何か補足することはありますか?
チャーリー・ワグナー — 最高財務責任者
いいえ、とてもよくおっしゃいました。優先順位は引き続き、イノベーションへの投資です。ここ数年、私たちは非常に積極的に取り組んできており、それが表れていると思います。
現在のパイプラインを見ると、40%のプログラムがここ数年のBDから恩恵を受けています。このように、私たちは積極的な機能を維持し、社内の取り組みをサポートするために外部のイノベーションに目を向け、今後も優先順位を高めていくつもりです。また、近年は希薄化を補うために自社株買いを続けていますが、その目的はイノベーションへの投資です。
Salveen Richter — ゴールドマン・サックス — アナリスト
ありがとうございました。
スージーリザ — インベスターリレーションズ担当上級副社長
サルヴィーンさん、ありがとうございます。次の質問は、チャックさんお願いします。
オペレーター
次の質問はコーウェンアンドカンパニーのフィル・ナドーからです。どうぞよろしくお願いします。
フィル・ナドー — コーウェン・アンド・カンパニー — アナリスト
こんにちは。質問をお受けいただきありがとうございます。イナクサプリンの第2/3相試験について、特に第2/3相の部分についてお聞きしたいのですが。その第2相部分のデータが開示されるかどうかについて、バーテックスの最新の考えはどうでしょうか。また、より一般的なことですが、第3相試験に進める用量をどのような基準で選択するのか、教えてください。その判断のために、どのような指標を検討されるのでしょうか。
Reshma Kewalramani — 最高経営責任者兼社長
フィル、イナクサプリンの試験、つまりAMKD(APOL1介在性腎疾患)を対象としたVX-147試験は、適応となる第2/3相試験プログラムです。投与量選択の基準は、12週時点の有効性を中心に設定されています。その基準は、タンパク尿です。
タンパク尿は、12週間の間に変化することが確認されています。GFRの変化については、そうはいきません。委員会がデータを見て判断することもできますし、試験の完全性を維持する必要性から、適切な方法で判断されます。しかし、第2相という重要なマイルストーンを乗り越え、投与量が決定されたという事実は、私たちも共有することになると思います。
しかし、臨床試験に参加している患者さんがいて、第3相の部分まで継続することを考えると、安定した整合性を維持することに注意しなければならないでしょう。
Phil Nadeau — コーウェンアンドカンパニー — アナリスト
それは助かります。ありがとうございます。
オペレーター
次の質問は、BMOのEvan Seigermanからです。どうぞよろしくお願いします。
エヴァン・セイガーマン — BMOキャピタルマーケッツ — アナリスト
どうも、皆さん。私の質問を聞いてくださってありがとうございます。また、好調な四半期について本当におめでとうございます。864について、この資産で臨床試験を再開するために見たことについて、もう少し詳しく教えていただけると幸いです。また、634番が前任者よりも成功する可能性がある理由も教えてください。ありがとうございました。
レシュマ・ケワラマニ — 最高経営責任者兼社長
やあ、エバン。こんにちは。アルファ1アンチトリプシン欠損症(AATD)プログラムについてのご質問ですね。
なぜ私たちがこの病気に関心を持つのか、半歩下がって皆さんに説明させてください。AATDは、VERTEXの戦略、つまり私たちの研究開発戦略にぴったりなのです。この病気は、原因となるヒトの生物学的性質がわかっている病気です。有効なターゲットがあり、ベンチからベッドサイドに移行できるバイオマーカーがあります。
この病気は、欧米で約10万人が罹患しています。ところで、この病気はタンパク質のミスフォールディングの病気であり、嚢胞性線維症の研究から私たちが少し知っている肺の病気でもあります。ですから、この病気は私たちにぴったりなのです。
VX-864の第2相試験でわかったことは、864は第一世代のAAT補正薬ですが、低分子化合物が初めてAATの機能レベルを上げることができたということです。これは、これまで実証されたことのないことです。また、探索的解析では、血清ポリマーレベルを90%以上減少させることができました。これらを総合して、私たちは今、このような状況にあります。
この2つのアプローチを並行して行っているのが、864よりも強力な医薬品を世に送り出すというアプローチです。それがVX-634です。VX-634は何倍も強力です。より優れた薬物様特性を持ち、第1相試験を開始しました。
それと並行して、VX-864も進めています。この分子は、より長期的な研究を行うための慢性毒性保険が適用されるからです。長期的な研究では、ポリマーの肝クリアランスを評価することができます。これは、私たちが見た血清ポリマーのクリアランスに戻るものです。ですから、肝臓でのポリマーのクリアランスと、AATの機能に対する長期的な影響を調べるのです。
私たちは、この2つのプログラムを並行して進めています。来年の今頃には、どの分子をさらに進めるべきかを評価するのに必要なデータが得られると思います。これが、AATDプログラムに関する私たちの現状です。
スージーリザ — 投資家向け広報担当上級副社長
次をお願いします。
オペレーター
次の質問は、SVB証券のデービッド・リジンガーからです。どうぞよろしくお願いします。
デービッド・ライジンガー — SVBセキュリティーズ LLC — アナリスト
どうもありがとうございます。特に今日の市場の憶測を考えると、この結果にもおめでとうと言わせてください。VX-548について質問なのですが、患者がオピオイドを長期投与できないため、慢性疼痛におけるこの製品の機会は明らかに非常に大きいと私は考えています。基本的には、1週間以内のオピオイドの処方であれば、もちろん既存の中毒の問題がない限り、オピオイド中毒のリスクがないと思われる患者さんについて、病院が安価なジェネリック医薬品に置き換えるかどうかということでしょうか。ありがとうございました。
Reshma Kewalramani — 最高経営責任者兼社長
デイビッド、急性痛に関する質問はスチュアートにお願いして、私は戻って慢性痛について一言だけ。スチュアート?
スチュアート・アーバックル — 最高執行責任者
ご質問ありがとうございます。はい。急性痛の市場についてですが、準備書面でも申し上げたように、いくつかの理由から非常に大きなチャンスだと考えています。
年間15億日の治療日数があり、その多くが病院内に集中しているにもかかわらず、90%以上がジェネリック医薬品であるという事実を申し上げましたが、その市場規模は現在40億ドルです。つまり、本当の問題は、ここで満たされていないニーズは何かということです。そして、そのアンメット・ニーズは、実は非常に大きなものなのです。あなたのコメントとは対照的に、実は、オピオイドの急性使用は、オピオイドの蔓延の原因として非常に顕著であり、よく認識されていることなのです。その結果、多くの州や病院システムで、オピオイドの使用に大きな制約が設けられました。
その結果、多くの州や病院システムでオピオイドの使用に大きな制約が設けられ、オピオイドの使用は大幅に減少しました。しかし、それでもなくならないのが、患者さんの中等度から重度の急性痛です。そのため、オピオイドのような習慣性や副作用がなく、効果的に痛みを緩和する薬剤が求められています。そのため、入院期間(平均2〜4日)が長い病院では、医療上のニーズが十分に満たされていないと考えています。
そして当然ながら、これらの患者さんは継続的な疼痛管理のために数日分の処方箋を持って退院し、小売店でその処方箋を記入することになります。このように、VX-548のプロファイルと、急性痛の治療に大きな変化をもたらす機会に、私たちはとても興奮しています。続いて、レシュマさん、慢性疼痛についてお願いします。
Reshma Kewalramani — 最高経営責任者兼社長
そうですね。David 私も、急性痛の大きな可能性に加えて、慢性痛の可能性については同意見です。慢性疼痛にチャンスがある理由は、2つあります。1つは、ご指摘のとおり、オピオイドを慢性的に使いたくないということ、そして率直に言って、急性期にもオピオイドを使いたくないということです。
もう1つは、オピオイドは慢性的な場面での有効性という点では、実はあまり優れていないということで、例えば神経障害性疼痛などでは、オピオイドは非常に有効です。最後に、VX-548の糖尿病性神経障害性疼痛を対象とした第2相用量設定試験を、今期中に開始する予定であることをお知らせしておきます。この試験については、ターゲットの遺伝子的検証だけでなく、前身の分子であるVX-150で神経障害性疼痛に関する薬理学的検証を行ったため、高い信頼性を持っています。
David Risinger — SVB Securities LLC — アナリスト
ありがとうございます。
司会
次の質問は、Truist SecuritiesのRobyn Karnauskasからお願いします。どうぞよろしくお願いします。
Kripa Devarakonda — Truist Securities — アナリスト
どうも、皆さん。質問をお受けいただきありがとうございます。ロビンに代わってクリパです。AATプログラムについて1つだけ質問させてください。
第1相試験から第2相試験に移行できるのはいつ頃だとお考えでしょうか?また、健常者試験を行うにはどれくらいの期間がかかるとお考えですか?また、以前、活性を見るために本当に短期間の試験を行うことができるというお話がありました。VX-864で行っていることを考えると、その考えは何か変わりましたか?もう1つ、CFのmRNAプログラムについて質問します。INDは今年後半に提出されるとのことですが、早ければいつごろになりますか?臨床への導入はいつごろになりそうですか?新しい治療法であることを考えると、INDの受理が遅れると予想される理由はあるのでしょうか?ありがとうございました。
Reshma Kewalramani — 最高経営責任者兼社長
はい、2つの質問に分かれています。1つは嚢胞性線維症のmRNAプログラムについて、もう1つはAATについてです。まず、嚢胞性線維症のmRNAについてです。
つまり、CFTRタンパク質が作られず、CFTRモジュレーターの効果が得られない5,000人ほどの患者さんに対して、mRNAの吸入療法を行うというアプローチです。IND-enabling試験は終了しています。INDは今年中に提出される予定です。そして、あなたの言うとおり、低分子化合物よりも複雑な製品です。
核酸療法や細胞療法はここ5〜8年、低分子は何十年も前から取り組んでいますしね。とはいえ、CFは命を縮める非常に深刻な病気です。そして、患者さんに利益をもたらす可能性のある医薬品を迅速に開発することに、すべての関係者が意欲を燃やしていると私は思います。もちろん、今後の電話会議で進捗状況をご報告できると思います。
しかし、私はこの進捗に非常に満足していますし、今年中にINDを提出する予定であることをうれしく思っています。AATプログラムでは、2つのことを並行して行っています。1つはVX-634をファースト・イン・ヒューマン試験に進めること、もう1つはVX-864をより長期間にわたって研究することです。この2つを並行して行っているのは、VX-864を長期間にわたって研究するための十分な毒性学的カバレッジがあるからです。このメカニズムで肝クリアランスを評価するには、長期間の試験が必要だと思います。
しかし、最初の……ヒトでの研究という点では、私たちの実績を見ていただければわかりますが、私たちは良いペースで動く傾向があります。例えば、来年の今頃には、634のヒトでの最初の研究のデータが得られ、第2相長期研究のデータが得られるでしょう。そして、634に続く分子がさらに臨床に登場すると、私は大いに期待しています。私たちは、すべてのプログラムにおいて、特にAATにおいて、私が望んでいるように、連続的なイノベーションとポートフォリオ・アプローチという戦略を実行しているのです。
Kripa Devarakonda — Truist Securities — アナリスト
ありがとうございました。
司会
次の質問はJPモルガンのジェシカ・ファイからです。どうぞよろしくお願いします。
ジェシカ・ファイ — J.P.モルガン — アナリスト
こんにちは。私の質問に答えてくれてありがとうございます。今夜はいい結果でしたね。先ほどの質問の続きです。
念のためお聞きしたいのですが、864の長期データを作成して肝臓ポリマーのクリアランスを評価し、より優れた薬物特性を持つ634をさらにデリスクするのでしょうか?次に、12歳以上の患者を対象とした試験で、年末までに新たなトリプル登録が完了する場合、解析時間を考慮してトップラインデータを期待できる時期を予想できますか?ありがとうございます。
Reshma Kewalramani — 最高経営責任者兼社長
そうですね。Jessicaさん、新しい3剤併用療法、Vanzacaftorの3剤併用療法、つまり121-561 tezacaftorですが、このプログラムの登録は、12+の両試験とも年内に完了すると予想しています。ちなみに、これらの試験の期間は1年です。ですから、来年のある時点ですべての投与が完了することになります。
少し時間はかかりますが、試験の終了とその後の結果については、かなり迅速に対応しています。しかし、重要なのは、治療期間が1年であるということです。864計画とAATDに関して、私たちが本当に達成しようとしていることは何でしょうか?ここで重要なことがあります。864では、低分子補正薬で初めて、AATの機能レベルが上昇することが確認されました。
治療効果の大きさは、第3相試験に移行するには不十分でしたが、生物学的活性を証明することができました。864の肝臓でのクリアランスを調べたいのは、第2相試験の事後分析で血清ポリマーレベルが90%低下したことから、長期間の治療で本当に肝臓でのクリアランスが得られると考えたからです。これが、私たちが検証している仮説です。また、長期間の治療が機能性AATの上昇につながるかどうかも評価するつもりです。
864は、この長期的な治療に基づいて、開発の後期段階に進む分子である可能性があるのでしょうか?はい、その可能性はあります。VX-634が、より強力で薬剤としての特性が優れているため、選択される分子である可能性はありますか?はい、その可能性はあります。だからこそ、私たちはこの2つのプログラムを並行して進めているのです。最終的に、おそらく最も重要なことは、AATDという病気に対する低分子化合物のアプローチが、この病気の肝臓と肺の両方の症状を治療できる可能性を秘めた唯一のアプローチであるということです。
そして、私たちが導き出したこの経路によって、その両方を並行して評価することができるのです。
Jessica Fye — J.P.モルガン — アナリスト
ありがとうございます。
オペレーター
次の質問はバンク・オブ・アメリカのジェフ・ミーチャムからです。どうぞよろしくお願いします。
発言者不明
ジェフに代わってジョーです。エクサセルについて質問です。最終的な商業展開について、どのように考えるべきかを教えてください。また、EUと米国で申請した後、最初の収益が出るまでのおおよそのスケジュールはどの程度でしょうか?2023年後半と考えていいのでしょうか?それとも2024年初頭でしょうか?ありがとうございました。
Reshma Kewalramani — 最高経営責任者兼社長
まず、現在の状況と、それに向けて取り組んでいる直近のマイルストーンからお話しします。次に、発売前の活動について、スチュアートにコメントを求めたいと思います。現在、私たちはEU、英国、米国への製品出荷に注力しています。
米国では来月11月にローリング申請を開始し、EUと英国では今年末までに申請を完了できるよう、順調に推移しています。スチュアート、そこから上市前の活動について少しお話いただけますか?
Stuart Arbuckle — 最高執行責任者(COO
1つは政策立案者と支払者、もう1つは、支払者や政策立案者とエクサセルを実際に管理することになる公認治療センターとの関係です。ご想像のとおり、規制当局の承認を待って、患者さんができるだけ早くエキサセルを利用できるよう、適切な条件を整えることが重要です。この疾患は、アンメットニーズが高く、支払者や政策立案者のコミュニティによって十分に認識されている疾患です。そのため、彼らとの話し合いは非常に生産的で実り多いものとなりました。
認定治療施設については、患者さんが集中している場所の近くにある認定治療施設を特定することが重要です。米国では、約25の州に患者さんが集中しており、患者さんの約90%がこの地域にいます。EUでは、イギリス、フランス、イタリア、ドイツの4カ国に約75%の患者さんがいます。
そこで、米国に約50カ所、欧州の4カ国に約25カ所の治療センターを設立し、規制当局の承認が得られれば、大半の患者さんに対応できるようになると考えています。繰り返しになりますが、私たちの施設との関わりは非常にポジティブなものでした。彼らは明らかに、患者に1回限りの機能的治癒をもたらす可能性を秘めたエクサセルのようなものの可能性に非常に期待しています。
発言者不明
素晴らしい。ありがとうございました。
スージーリザ — 投資家向け広報担当上級副社長
あと1回だけ時間をください。
オペレーター
次の質問はUBSのコリン・ブリストウからです。どうぞよろしくお願いします。
発言者不明
こんにちは、コリンの[Inaudible]です。ご質問をいただきましてありがとうございます。そこで、2つの質問をさせていただきます。まず1つ目は、御社のCFベースのビジネスについてです。
アッヴィのテザカフトールによる最新の3剤併用療法がclinicaltrials.govに掲載されましたが、競争上の脅威をどのようにお考えでしょうか?2つ目の質問は、CRISPRを用いたDMD治療薬についてです。IND申請は来年になるとのことですが、いつごろになるとお考えですか?では、このプログラムの最初の臨床データはいつ頃見られるとお考えですか?例えば、糖尿病のVX-880プログラムのように、単一患者データを公開するようなことはお考えでしょうか?ありがとうございました。
Reshma Kewalramani — 最高経営責任者兼社長
質問が2つあります。ひとつはCFについて、もうひとつはDMDについてです。まず、DMDの質問をお受けします。まず、皆さんに簡単な背景を説明します。
DMDに対する私たちのアプローチは、マイクロジストロフィンに焦点を当てた他の多くのアプローチとは異なることを思い出してください。私たちのアプローチは、エキソンスキッピングを中心としたin vivo遺伝子編集アプローチであり、完全長、あるいはそれに近いジストロフィンを産生するものです。そして、このアプローチを信じる理由は、私たちが目にするヒトの遺伝学的特徴にあります。例えば、ベッカー型筋ジストロフィーでは、ジストロフィンがほぼ全長であるため、この病気はDMDの中でもかなり軽症の部類に入ります。
マイクロジストロフィンのアプローチでは、このようなヒトの遺伝学的な背景がないのです。私は、このプログラムの進展にとても満足しています。現在、IND取得を目指した試験を行っているところです。現在、治験薬製造許可申請のための試験を行っており、来年には完了し、治験薬製造許可申請を行う予定です。
しかし、このプログラムは細胞や遺伝子の領域で、それなりの期間、それなりに少数の患者を対象にしたもので、CTX001や1型糖尿病プログラムに非常によく似ており、私たちの位置づけが分かると思います。CF事業については、これまで何度もお話ししてきましたが、TRIKAFTAは非常に高いハードルを設定しています。この病気の患者さんの90%まで治療することができます。私たちはすでに次のプログラムを進めています。
これはバンザカフトールプログラムです。今年、第3相の登録が完了する予定です。もし可能であれば–これは無理な注文ですが、もしTRIKAFTAよりも優れていることが可能であれば、vanzacaftorのトリプルプログラムにはその可能性があります。ヒト気管支上皮の試験や第2相試験で、TRIKAFTAよりも塩化物輸送が優れているのです。
研究間の比較をする必要があります。しかし、第2相試験では、TRIKAFTAよりもさらに優れている可能性があるようです。そして今、私たちは、過去5,000人のCF患者のために、初めてmRNA療法を導入する寸前まで来ているのです。私たちのCFTRモジュレーターから恩恵を受ける患者さんはかつてなく多く、すべての患者さんのために何かを手に入れられるという、このような立場になったことはありません。
私たちの手が気に入ったので、さらなるデータを共有することを楽しみにしています。
オペレーター
これで質疑応答は終了です。最後に、スージー・リサさんに閉会の辞をお願いしたいと思います。どうぞよろしくお願いします。
スージーリザ — インベスターリレーションズ担当上級副社長
チャック、ありがとうございました。また、みなさんからのご質問もありがとうございました。また、質問をお寄せいただいた皆様、ありがとうございました。
以上です。他の翻訳希望やご感想をいただけると嬉しいです。
*誤訳などがあるかもしれませんでの参考程度にしていただき投資は自己判断でお願いします。
ブログ運営の励みになりますので、お手数ですが、応援の1日1クリックをよろしくお願い致します。
↓↓<応援クリックお願いします>


