イーライリリー・アンド・カンパニー ( LLY )2022年第3四半期決算説明会の日本語訳です。
ガイダンスが悪く株価が下落してますね。これまで株価は右肩上がりだったので調整があるかもしれないですね。
今後の上市予定の新薬は期待出来る物ばかりなので魅力なので安くなれば買い増したいと思ってます。
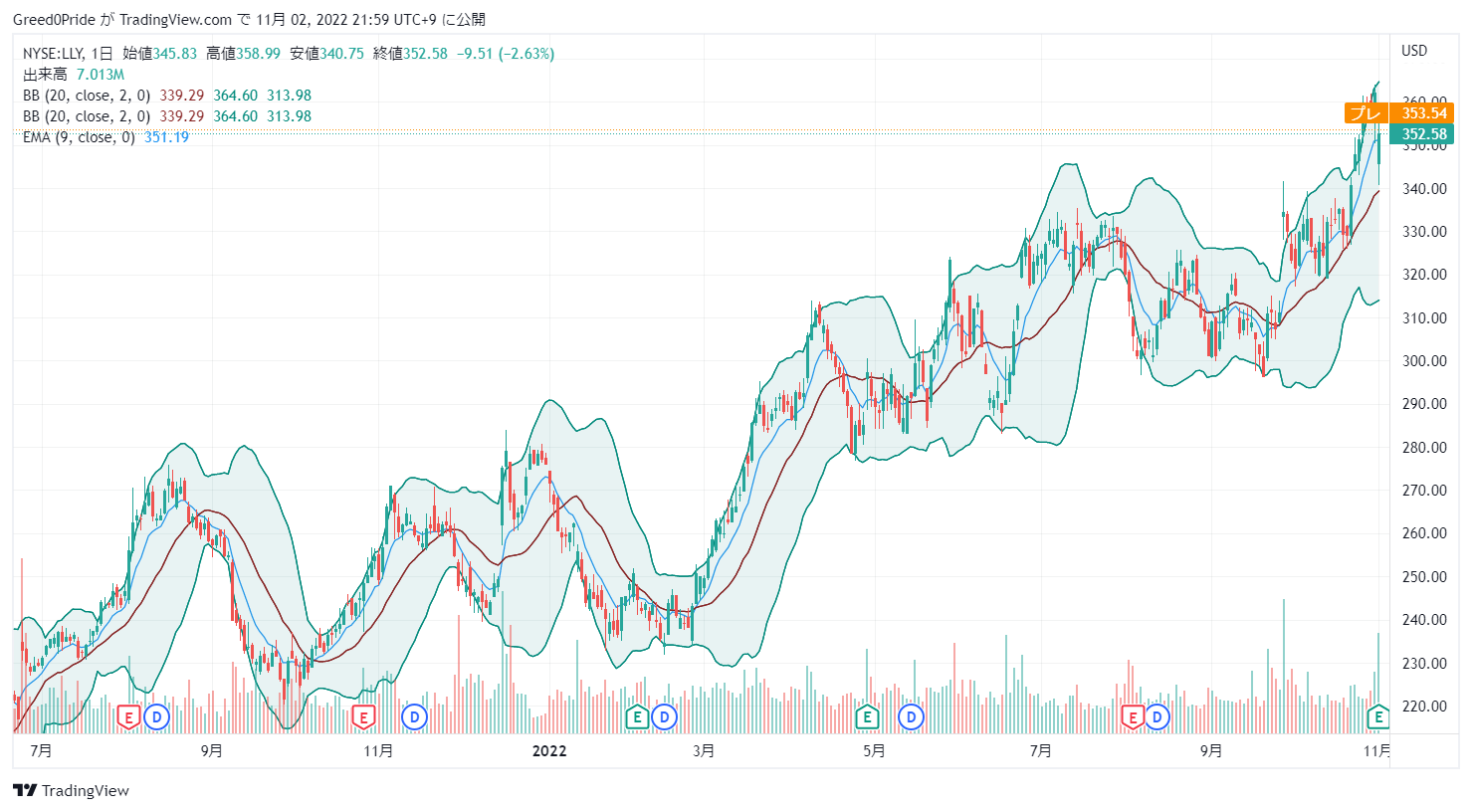
イーライリリー・アンド・カンパニー ( LLY )株価
前回の2022年第2四半期決算説明会はこちらです。
イーライリリー・アンド・カンパニー (LLY )2022年第3四半期決算説明会
Call participants:
Joe Fletcher — Senior Vice President, Investor Relations
Dave Ricks — Chairman and Chief Executive Officer
Anat Ashkenazi — Chief Financial Officer
Dan Skovronsky — Chief Scientific and Medical Officer
Chris Schott — JPMorgan Chase and Company — Analyst
Mike Mason — President, Lilly Diabetes
Terence Flynn — Morgan Stanley — Analyst
Umer Raffat — Evercore ISI — Analyst
Steve Scala — Cowen and Company — Analyst
Ilya Yuffa — President, Lilly International
Geoff Meacham — Bank of America Merrill Lynch — Analyst
Mohit Bansal — Wells Fargo Securities — Analyst
Seamus Fernandez — Guggenheim Partners — Analyst
Chris Shibutani — Goldman Sachs — Analyst
Jake Van Naarden — Chief Executive Officer of Loxo Oncology at Lilly and President of Lilly Oncology
Colin Bristow — UBS — Analyst
David Risinger — SVB Securities — Analyst
Louise Chen — Cantor Fitzgerald — Analyst
Andrew Baum — Citi — Analyst
Anne White — President, Lilly Neuroscience
Evan Seigerman — BMO Capital Markets — Analyst
Tim Anderson — Wolfe Research — Analyst
Kerry Holford — Berenberg Capital Markets —
Robyn Karnauskas — Truist Securities — Analyst
More LLY analysis
2022年11月01日午前9時00分
オペレーター
皆様、お待たせしました。リリーの2022年第3四半期決算の電話会議へようこそ。[この電話会議は録音されています。それでは、司会の投資家向け広報担当上級副社長、ジョー・フレッチャーに会議を引き継ぎたいと思います。どうぞよろしくお願いします。
ジョー・フレッチャー — 投資家向け広報担当上級副社長
ありがとう、ロイス、そしておはようございます。イーライリリー・アンド・カンパニーの2022年第3四半期の決算説明会にご参加いただき、ありがとうございます。私は、投資家向け広報担当上級副社長のジョー・フレッチャーです。本日の電話会議には、リリーの会長兼CEOのデイブ・リックス、最高財務責任者のアナト・アシュケナージ、そして、博士(医学博士)の3名が参加しています。 Dan Skovronsky、Lilly Neuroscience社長Anne White、Lilly International社長Ilya Yuffa、Loxo@Lilly社長Jake Van Naarden、Lilly Diabetes社長Mike Mason、Lilly ImmunologyおよびLilly USA社長Patrik Jonsson、さらにIRチームのMike Sprengnether、上羽研人、Luren Zierkeが参加しています。この電話会議では、当社の現在の予想に基づく予測や将来の見通しに関する記述を行うことが予想されます。実際の業績は、様々な要因により大きく異なる可能性があります。実際の業績に影響を与えうる重要な 要素は、当社の最新のフォーム 10-K およびそれに続くフォーム 10-Q と 8-K で米国証券取引委員会に提出された書類に記載されています。当社が提供する製品およびパイプラインに関する情報は、投資家の皆様の便宜を図るためのものです。また、この情報はプロモーションを目的としたものではなく、処方を決定するのに十分なものではありません。準備した発言に移る際、私たちのコメントは非GAAPベースの財務指標に重点を置いていることにご留意ください。
それでは、Daveに電話をつなぎます。
デイブ・リックス — 会長兼最高経営責任者
さて、ジョー、ありがとう。この3ヶ月間、私たちは引き続き戦略を成功裏に実行しました。商業面では、目覚しい立ち上がりを見せた「モンジャロ」をはじめ、最近上市した医薬品が数量ベースで力強い成長を遂げました。同時に、後期開発パイプラインを進展させ、来年末までに4つの新薬の上市を目指すとともに、初期開発パイプラインや遺伝子治療などの新しい治療法にも投資を行いました。
また、製品に対する需要の高まりに対応し、将来の上市に備えるため、製造拠点の拡大にも継続的に投資してきました。アンメットニーズが高く、患者さんの転帰を改善するためにリリーが新薬の開発を進めている2つの領域、肥満症とアルツハイマー病に焦点を当てます。肥満症については、成人の肥満症に対するティルゼパチドのファスト・トラック指定がFDAから承認され、この有望な医薬品をより早く患者さんにお届けできるようになったことを嬉しく思っています。また、肥満症の患者さんの転帰の改善を評価するための第3相罹患率・死亡率・肥満症試験であるSurmount MMOを開始します。
アルツハイマー病では、ドナネマブのフェーズ3試験であるTRAILBLAZER-ALZ 2が、2023年半ばのトップライン発表に向けて進行中です。また、TRAILBLAZER-ALZのデータに基づく早期承認に向けて、FDAとの協働を継続しています。また、アトピー性皮膚炎を対象としたlebrikizumabの申請が米国とEUの両方で完了したことを発表しました。
ドナネマブ、ペルティブルチニブ、ミリキズマブの申請もすでに完了しています。現在から2023年末までの間に4つの新薬を上市できる可能性があり、大変うれしく思っています。リリーにとって、新製品の上市は前例のないことであり、この業界で最も目覚しいスピードで進んでいることは間違いありません。スライド4の戦略的成果物に目を向けます。
第3四半期の売上高は、恒常為替レートベースで7%の伸びを示しました。全世界での販売量は14%増と堅調に推移しました。主要製品の成長率は19%で、現在では中核事業の売上高の70%を占めており、これは当社の販売製品群の若さと耐久性を反映したものです。Verzenio、Taltz、Jardiance、そしてMounjaroやTrulicityなどの当社のアンカー(聞き取りにくい)医薬品が引き続き世界的に採用されていることは心強いことです。
第3四半期の非GAAPベースの売上総利益率は79%で、前年同期とほぼ同水準でした。非GAAPベースの営業利益率は28.9%で、これには買収したインプロセス研究開発費および開発マイルストーン費用による約90ベーシスポイントのマイナスの影響が含まれています。パイプラインのマイルストーンについては、第2四半期の決算発表以降、いくつかの重要な最新情報をお伝えしています。例えば、成人肥満症に対するtirzepatideのFDAによるファスト・トラック指定(2023年半ばまでに申請完了予定)、成人2型糖尿病に対するMounjaroのEUおよび日本での承認、米国およびEUでのlebrikizeroの承認、などがあります。また、RET融合遺伝子陽性の進行性・転移性固形がんでは、腫瘍の種類に関係なくFDAから加速承認され、RET融合遺伝子陽性の非小細胞肺がんでは、成人における従来の承認が得られました。
詳細は後ほどダンからご説明しますが、アクロス社の買収を発表できたことを嬉しく思います。アクロス社は、障害を伴う難聴を抱える患者さんの聴力の回復、改善、維持を約束する遺伝子治療への取り組みを加速させることを目的としています。この買収は、リリーにおける遺伝子医学の発展に対する我々の継続的なコミットメントを示すものです。最後に、私たちは株主の皆様に9億ドル近い配当金をお渡ししました。スライド5では、いくつかの重要な人事、COVID-19抗体、ESGのアップデートなど、第2四半期決算説明会以降の重要なイベントの一覧をご覧いただけます。
私たちは、人事・多様性担当の上級副社長であるスティーブ・フライが、35年以上勤めた後、間もなく退職することを発表しました。当社の多様性、平等性、包括性の推進に重要な役割を果たし、地域とセクターにおける最高の雇用主となるための努力をリードしてくれたスティーブに感謝したいと思います。また、スティーブの後任として、エリック・ドージャーを迎えます。ドージャーはリリーで25年近い経験を持ち、優れた業績をもたらす人材とチームの育成に優れた実績を持っています。
彼は、Lillyが今後の野心的な成長目標を達成するために不可欠な人材戦略を推進するリーダーとして適任であると確信しています。8月には、COVID-19抗体beptilizumabを、総販売代理店を通じて州、病院、その他の特定のプロバイダー向けに購入できるようにしました。第3四半期には、米国政府に60万回分のベブテロビマブを約1億1,000万ドルで追加出荷しました。
これらは、製品交換プログラムを通じて、経済的に弱い立場の患者さんに使われる予定です。現時点では、ベプチリズマブに関する米国政府からの追加発注は想定していません。ESGへの取り組みに関しては、第1回サステナビリティボンドの配分と影響に関する報告書を発行し、21年9月のサステナビリティボンドの発行以来、様々なサステナビリティプロジェクトに約1億2800万ユーロを配分したことを明らかにしました。
この報告書と当社のESGプログラムの他の多くの側面に関する詳細については、リリーESGウェブサイトをご覧ください。それでは、アナトから第3四半期の業績について、より詳しい説明をさせていただきます。
アナト・アシュケナージ — 最高財務責任者
ありがとう、デイブ。第3四半期の業績について説明する前に、買収したIPR&Dおよび開発マイルストーン費用について、当社がどのように説明するかの変更点を強調させてください。10月中旬にSECに8-Kを提出し、第3四半期の買収によるIPR&Dおよび開発マイルストーン費用による影響をより早く投資家に明確に説明することができました。今後、この情報は、四半期ごとに当社の Investor Relations ウェブサイトで公開される予定です。
次に、業績についてご説明します。スライド6は、2022年第3四半期の業績をまとめたもので、私は非GAAPベースの業績について全体的なコメントを中心に述べます。第3四半期の前年同期比では、いくつかの注目すべき項目が影響しています。為替レートは、第3四半期の収益が2%、恒常通貨ベースでは7%増加したため、今期の収益におよそ430ベーシスポイントの影響を及ぼしました。
日本におけるMounjaroの販売・流通権に関する販売提携契約に関連する8,600万ドルの収益を認識し、アリムタの米国Fed失効による影響を初めて四半期全体で受け、COVID-19抗体の売上増加およびCOVID-19治療薬Olumiantの売上減少が業績に影響を及ぼしました。日欧米で特許切れとなったアリムタ、COVID-19抗体、COVID-19治療薬オルミエントの売上を除くと、売上は四半期で9%、恒常為替レートベースで14%増加し、当社の中核事業の堅調なモメンタムを浮き彫りにしています。
売上総利益率は前年同期比でほぼ横ばいでした。実現価格の低下の影響、インフレと物流費による費用の増加は、COVID-19治療薬Olumiantの売上減少の影響や為替の有利な影響など、良好なプロダクトミックスによって相殺されました。当四半期の営業費用合計は1%増加しました。マーケティング費用、販売費及び一般管理費、研究開発費の伸びは、買収したIPR&Dおよび開発マイルストーン費用の減少によりほぼ相殺され、営業費用の伸びは約350bps減少しました。マーケティング費及び販売費及び一般管理費は、主に「Mounjaro」の発売にともなう費用の増加により 2%増加しましたが、為替のプラスの影響により一部相殺されました。
研究開発費は、後期開発資産の開発費の増加により6%増加しましたが、為替の好影響とCOVID-19抗体の開発費減少により一部相殺されました。第3四半期の営業利益は、主に売上総利益率の上昇により6%増加しましたが、営業費用の増加により一部相殺されました。売上高営業利益率は、買収したIPR&Dおよび開発マイルストーン費用に起因する約90ベーシスポイントのマイナスの影響を含み、28.9%となりました。第3四半期の実効税率は10.7%となり、前年同期に比べ360bps減少しました。
この減少は、主に2017年税法の施行に関連する税金の有利な影響によるものです。ボトムラインでは、1株当たり利益は今期約12%増加し、1.98ドルとなりました。買収したIPR&Dおよび開発マイルストーン費用と、前年同期の0.17ドルに対し、2022年第3四半期は0.06ドルのマイナスの影響を受けました。スライド 8 では、価格、レート、数量が収益成長に与える影響を定量的に示しています。
当四半期は、主に米ドルに対するユーロ安に関連する為替変動により、4%の減収となりました。主要地域別業績についてご説明します。当四半期、米国は台数の増加に牽引され、売上は11%増加しました。
は、15%の数量増により11%の増収となりました。アリムタ、COVID-19抗体、COVID-19治療薬オルミエントの収益を除くと、米国の収益は主に主要成長製品に牽引されて20%増加しました。米国における
これは主に、セグメントミックスによるヒューマログの実現価格の低下とインスリン・リスプロ注射剤の定価引き下げによるものです。欧州に移動。売上高は、主にTrulicity、Jardiance、Verzenio、Taltzの数量増により、恒常通貨ベースで11%増加しました。欧州における事業の勢いを後押しし、2021年6月に独占権を失ったアリムタの特許切れの影響を基準期間の比較から受け、継続的な成長を見込んでいます。
日本では、第3四半期の売上は恒常為替レートベースで2%の減少となりました。新薬の成長と、日本における「モウンジャロ」の販売・流通権に関する販売提携契約に関連する収入は、2021年6月に後発品参入を控えたサインバルタやアリムタなどの特許切れ製品の減少の影響が続いたものの、それを上回った。日本では、主要な成長製品の規模を拡大し続け、特許切れの影響が収まる2023年以降に成長が回復すると見込んでいます。中国では、引き続きゼロCOVID政策措置の影響を受けているため、売上高は恒常通貨ベースで10%減少しました。
また、NR DLXを有する現地競合他社からのTyvytに対する競争圧力が高まっている影響も見られます。さらに、Humalogの数量ベース調達による価格影響が最初の四半期でフルに発生しました。当社の革新的なポートフォリオに対する高いアクセスレベルを維持することが期待されるため、今後、当社の数量は純増加を加速させるものと考えています。その他の地域の収益は、第3四半期に恒常通貨ベースで6%減少しましたが、これは主に顧客の購買パターンに起因するものです。
この地域の累計売上高は前年同期の為替レートを適用して8%増加していますが、これは基調的なトレンドをより的確に表しています。スライド 9 に示すとおり、当社の主要な成長製品は引き続き水域全体での力強い数量増加を牽引しています。これらの製品は、当四半期において約18%の数量増加を実現し、引き続き当社の現在の業績と将来の見通しを下支えしています。スライド10は、主要成長製品の貢献をさらに強調するものです。
今期、これらのブランドは19%の成長、恒常為替レートでは25%の伸びを示し、売上高は46億ドル、コアビジネスの売上高の70%を占めました。Verzenio、皮膚科領域のTaltz、Jardianceなどの製品は、競合他社の成長を上回り、それぞれのクラスで新薬の市場シェアでリーダーとなっています。注射用インクレチン製剤の市場においては、今後もさらなる成長のための大きな機会があると考えています。米国でのMounjaroの発売成功に加え、Trulicityは世界的に力強い成長を続けています。
現在、インクレチンの生産は社内計画を上回っており、この業績を持続させることに引き続き注力しています。Trulicityに対する旺盛な需要は、一部、競合品のGLP-1の入手が困難な状況にあるため、ほとんどの国際市場において、拡大する需要に対応することが困難な状況が続いています。このような状況において、当社は、既存患者への影響を最小限にするため、これらの市場において新規患者へのTrulicity投与開始を控えるようコミュニケーションをとるなど、市場の需要に応えるべく懸命に努力しています。米国では、原稿量は堅調に推移しています。
また、生産能力を増強する一方で、卸売業者の皆様には、Trulicityの注文の再入荷が断続的に遅れる可能性があります。スライド11に移ります。Mounjaroの発売後4ヶ月間の急速な普及に満足しています。Mounjaroの新規治療開始の約70%は、2型糖尿病注射剤インクレチンクラスにナイーブな患者さんで、Trulicityからの切り替えは10%未満となっています。
同業者交渉を進めており、アクセスレベルは、コマーシャルおよびパートDの総生命数の約45%まで2倍以上に拡大しました。そして、アクセスの拡大に伴い、有償スクリプトの割合も増加し始めるはずです。当社は、2型糖尿病の患者さんにMounjaroを提供することに重点を置いており、これらの患者さんへのアクセスと供給を確保するための措置を講じる予定です。これらの措置は、処方量にマイナスの影響を与える可能性がありますが、純収益には影響しないものと考えています。
米国で発売されたMounjaroの2型糖尿病治療薬には、強い有効性と良好な顧客体験に支えられ、かつてないほどの需要が見られました。また、競合他社のインクレチンの入手可能性も、Mounjaroの需給を評価する上で重要な要素となっています。インクレチン事業全体で急増する需要に対応するため、当社は製造能力を大幅に追加する計画を立てています。2023年にはノースカロライナ州のRTPサイトがフル稼働し、その能力と他のサイトでの追加措置や拡張を合わせると、2023年末にはリリーのインクレチン製造能力は2倍になると予想しています。
スライド12では、資本配分に関する最新情報をお伝えしています。年初来の9ヵ月間、当社は研究開発費、事業開発費、設備投資などを組み合わせ、将来の成長を促進するために68億ドルを投資しました。また、約27億米ドルの配当金を株主に還元し、15億米ドルの自社株買いを行いました。当社の資本配分の優先順位は、販売中の主要製品および上市予定の新製品への資金提供、製造能力の増強、パイプラインへの投資、将来の成長見通しを高めるための外部イノベーションの追求、そして余剰資本の株主への還元です。
スライド13は、2022年の財務ガイダンスを更新したものです。通期の売上高見通しには、前回のガイダンス更新時から為替による逆風を3億ドル追加しており、当初のガイダンスと比較して通期で約10億ドルの為替による逆風の影響を受けます。売上総利益率、販売費及び一般管理費、研究開発費の見通しについては、変更ありません。当社のガイダンスには、買収したIPR&Dおよび開発マイルストーン費用約6億7,000万ドルが含まれており、これは年初来の9ヵ月間の費用合計を反映しています。
なお、第4四半期において、重要なIPR&D費及び開発マイルストーン費は計上していません。また、このガイダンスには、買収の可能性、すなわち事業開発または買収にともなう影響は含まれていません(審理不 了となった買収を含む)。非GAAPベースの営業利益率は、前年同期と変わらず、約29%でした。報告ベースでは、GBA1遺伝子治療薬の上市時期の変更による無形固定資産の減損が影響し、営業利益率は約26%になる見込みです。
その他の収益及び費用のNon-GAAPベースの範囲は変更されていません。報告ベースでは、2022年第3四半期中の株式投資損失(純額)の影響を反映し、その他の収益および費用は6億ドルから7億ドルの範囲で費用化される見込みです。年初来の9カ月間の当社の税率およびEPSには、税務上の研究開発費の資産計上および償却を義務付ける2017年税法上の規定の有利な影響が含まれています。通年の財務ガイダンスでは、引き続きこの規定が議会で延期または廃止され、2022年通年で適用されることを想定しています。
この繰り延べ廃止が年内に実施されると仮定した場合、第4四半期の非GAAPベースの税率は、2022年通年の研究開発費の即時費用化による累積税効果を含めて約22%となると予想しています。この規定が今年度中に延期もしくは廃止されない場合、報告税率および非 GAAP 方式による税率は約 10%から 11%になると予想しています。これらの変更に基づき、報告されている EPS のガイダンスを 0.46 ドル引き下げ、1 株当たり 6.50 ドルから 6.65 ドルの範囲とし、2022 年の非 GAAP EPS のガイダンスを 0.20 ドル引き下げ 7.70 ドルから 7.85 ドル の範囲としました。非GAAPベースのEPSレンジを0.20ドル引き下げたのは、為替のマイナス影響と、第3四半期に買収したIPR&Dおよび開発マイルストーンの費用増による0.06ドルの影響によるものです。
次に、ダンに電話をかける前に、来年について考え始めるにあたり、損益計算書全体の押し引きについて少し考えを述べたいと思います。まず、売上高ですが、私たちはコアビジネスの成長見通しに自信を持っています。Mounjaro」の好調な立ち上げや新製品の発売など、成長前の製品全般でポジティブなモメンタムを構築できると考えています。2023年には、当社の次の潜在的な上市の波による最初の収益は部分的なものにとどまると予想していますが、ドナネマブ、ピツブルチニブ、ミリキズマブ、レブリキズマブが、継続的な成長のためのさらなる触媒として機能することを期待しています。
2023年は、米国でのアリムタの特許切れの影響が通年で発生し、第2四半期半ばから後発品によるアリムタの売上が減少し、為替による1桁台前半の逆風が予想されます。COVID-19抗体の収益については、引き続きベブテロビマブを購入可能な状態にする予定です。ただし、その需要はCOVID-19の症例数だけでなく、進化する亜種や利用可能な治療法にも依存します。私たちは、COVID-19抗体はリリーの長期的な成長の主要なドライバーにはならないと引き続き考えています。
私たちは、有望な研究開発の機会を進め、製造能力を拡大し、複数の新製品の上市を支援するために、将来に向けた投資を行います。インフレが続くと仮定すると、2023年にもその影響が現れると予想されます。また、当社の最も重要な資産の一つである優秀な従業員に対して、部分的にはインフレ圧力によるものですが、将来の成長を約束する適切な能力を確保するための報酬増額を通じて、大規模な投資を行う予定です。これらの投資は、2023年の営業利益率の拡大を減速させますが、中長期的にトップクラスの売上成長と営業利益率の拡大を維持するために、パイプラインと新製品の発売機会を最大化するために不可欠なものです。
詳細については、12月13日に開催するガイダンスコールでご説明したいと思います。それでは、研究開発の進捗状況について、ダンにお話しを伺いたいと思います。
Dan Skovronsky — 最高科学・医学責任者
Anatさん、ありがとうございます。2022年もリリーの研究開発にとって素晴らしい1年でした。Mounjaroの承認に加え、2023年末までに発売可能な4つの新薬、ピルトブルチニブ、ミリキズマブ、レブリキズマブ、デネティミの承認申請も完了しました。さらに、すべての主要領域において、有望な次世代アセットで初期段階のパイプラインを進展させました。
さらに、成長を続ける核酸医薬のポートフォリオでは、能力の向上とプロジェクトの推進を継続しました。コアビジネスの研究開発に関する最新情報をお伝えする前に、COVID-19抗体に関するAnatの最新情報を簡単に補足させてください。ベブテロビマブは実用化されましたが、新しい高度に変異した株の出現を注意深く見守っています。シュードウイルスのデータに基づいて、我々はベブテロビマブが新しいBQ変種に対して中和することはないと考えています。
しかし、私たちの研究所には広範な中和抗体の候補があり、ニーズがあり、保健当局との協力体制が整っていれば、前倒しで提供することを検討することができます。次に、当社の中核となる研究開発ポートフォリオについて説明します。スライド14は、10月28日現在のパイプラインの機会を示しており、スライド15は、今年の主要なイベントの可能性を示しています。前回の決算説明会以降の重要な進展について、治療領域別に説明します。
まず、糖尿病と肥満症からです。ティルゼパチドについては、いくつかのアップデートがあります。2型糖尿病に関しては、第2四半期に米国で承認されたMounjaroに加え、EUと日本でも承認されたことをお知らせします。
慢性体重管理に関しては、ティルゼパチドがFDAからファスト・トラックに指定されたことを嬉しく思います。ファストトラック指定は、アンメット・メディカル・ニーズを満たす可能性のある深刻な症状を治療するための新しい治療法の開発を促進し、審査を迅速化するために設定されたものです。当社は、本年中に、終了したSurmount-1試験および2023年4月末までに終了予定のSurmount-2試験の結果に基づき、順次申請を開始する予定です。サーマウント-2の結果が良好であると仮定すると、これらのデータを用いて2023年半ばにローリング申請を完了し、早ければ来年末に規制当局による措置の可能性が出てくるものと思われます。
私たちは、肥満症に悩む成人の方々に一刻も早くtirzepatideをお届けできるよう、努力しています。また、肥満症における罹患率および死亡率の第3相試験であるtirzepatide Surmount-MMOの試験デザインについて発表しました。Surmount-MMOは、糖尿病を伴わない肥満症の成人を対象に、ティルゼパチドによる治療をプラセボと比較して評価し、従来の心血管イベント以外の幅広いアウトカムに対するティルゼパチドの効果を測定するものです。主要評価項目として、全死亡を含む5段階のCVコンポジットから心血管イベントの発生を測定しています。
また、従来のMACE3イベント、2型糖尿病の発症リスク低減、腎臓の有害事象などの主要な副次評価項目も組み込んでいます。Surmount-MMOでは、臨床現場をよりよく代表する、より広範なリスク集団を対象に、イベントの一次予防と二次予防の両方について研究しているのです。現在、Surmount-MMO試験は開始されており、今後、結果を公表することを楽しみにしています。Surmount-MMOは、Tirzepatideの開発計画に新たに追加されたものに過ぎません。
私たちの目標は、慢性的な体重管理を実証するだけでなく、体重減少の結果、複数の転帰にわたって改善することを実証することです。私たちは、2型糖尿病、肥満、およびその他の肥満に関連する代謝性疾患を有する患者さんの健康状態に影響を与えるティルゼパチドの可能性に非常に自信を持っています。糖尿病領域では、週1回投与型インスリン製剤「FC」の第3相試験を開始し、今後数カ月で最終の第5相試験となる「クイント」の登録試験を開始する予定です。また、リリーが近々発表するTempoパーソナライズド糖尿病管理プラットフォームの主要コンポーネントであるTempoスマートボタンと医療機器のFDA承認を取得しました。
今年中にこのプラットフォームの市場導入を開始できることを嬉しく思っています。オンコロジーに移ります。この試験は、HR陽性/HER2陰性、リンパ節陽性の早期乳がんで、再発リスクの高い成人患者を対象に、Verzenioと内分泌療法を併用するアジュバント試験で、MONARCH-Eの中間解析が実施されました。この解析結果は、来月開催されるサンアントニオ乳がんシンポジウムで発表される予定です。
私たちは、今回の結果にとても興奮しており、データを公開できることを楽しみにしています」と述べています。ベルゼニオは、アジュバント療法で承認された唯一のCDK4/6阻害剤であり、生命を脅かす不治の転移性疾患の発症リスクを大幅に低減するベルゼニオの能力を高く評価しています」と述べています。また、FDAがRET遺伝子融合型局所進行性・転移性固形腫瘍の前治療を行う成人患者に対し、腫瘍の種類に関係なくRetevmoの加速承認を付与したことを発表しました。また、FDAが承認した検査によりRET遺伝子融合が検出された局所進行性または転移性の非小細胞肺がん成人患者に対するRetevmoの従来の承認も付与されました。
レテブモにより、より多くの腫瘍型の患者さんに有意義な臨床的利益を提供する機会を得たことに感謝しています。また、ピルトブルチニブの5番目の第3相試験で患者への投与を開始しました。この最新の試験は、BTK阻害剤未使用の慢性リンパ性白血病患者を対象に、ピルトブルチニブとイブルチニブを比較評価するヘッド・トゥ・ヘッドの試験です。なお、ピルトブルチニブは現在FDAで優先審査中であり、BTK阻害剤による治療歴のあるマントル細胞リンパ腫を対象として、2023年初頭に規制当局の対応が予定されています。
また、BTK阻害剤による治療歴のある患者のCLLに対する承認経路を早める可能性についても、FDAと話し合いを続けています。免疫学への切り替え 当社は、最近開催された2つの皮膚科学会において、中等症から重症のアトピー性皮膚炎患者を対象としたレブリキズマブ単剤療法の第 3 相試験の 52 週目の詳細な結果を発表しました。この維持療法データは、16週間の導入療法期間中に臨床効果が得られた患者さんにおいて、lebrikizumabが強固で持続的な皮膚クリアランスをもたらし、かゆみ、睡眠、QOLを改善することを示しました。
また、注目すべきは、lebrikizumabの投与頻度を少なくすることで、2週間に1回の投与と同様の改善が得られることが示唆された点です。2,000人以上の患者さんを対象とした試験で得られたデータに基づき、当社は、lebrikizumabが中等度から重度のアトピー性皮膚炎の治療の第一選択薬となり得ると考えています。この疾患は、多くの多様な患者さんに新しい選択肢を提供する必要性が非常に高いものです。多様な患者さんへの取り組みの一環として、当社は、アトピー性皮膚炎の有病率が不当に高く、しばしばより重症な症状を呈する肌の色の異なる人々を対象に、lebrikizumabの評価を行う革新的な臨床試験を最近開始しました。現在、FDAにBLAを申請しています。
また、欧州における皮膚科適応のlebrikizumabの開発・販売権を有するアルミラル社は、EMAに承認申請を行っています。米国、EUともに来年末には規制当局の決定がなされる見込みです。この慢性疾患に苦しむ患者さんに、アルミラル社とともに、この重要な医薬品をお届けできることを楽しみにしています。
次に、遺伝子医薬への取り組みです。ANGPTL3 siRNAは、動脈硬化性心疾患を対象としたフェーズ2開発段階に移行しました。これは、当社が初めてフェーズ2に進出したsiRNA資産です。この分子は、昨年、概念実証のデータを共有したLp(a) siRNAとともに、私たちの遺伝子医薬のポートフォリオを使用して心血管系の転帰を改善する見込みがあると楽観視しています。
遺伝子治療の分野では、Prevail Therapeuticsのプログラムを進めている致死性の神経変性疾患の患者さんを支援する機会に期待しています。特に、プログラニュリン遺伝子治療プログラムから得られたバイオマーカーの結果を、今後開催される前頭側頭型認知症の学会で発表することを楽しみにしています。Prevailでの遺伝子治療の経験をもとに、遺伝的難聴の治療に革新的な遺伝子治療のアプローチをもたらすであろうAkouosとその才能あるチームを迎えることができ、大変嬉しく思っています。難聴は、アンメット・ニーズが高い分野でありながら、これまで薬理学的な開発の対象とはなっていませんでした。
内耳に投与する遺伝子治療による感覚神経性難聴の治療は、患者さんのために技術的進歩の機が熟している分野であると、私たちは考えています。最後に、アルツハイマー病についてですが、前回の電話会議以降、いくつかの重要な進展がありました。アルツハイマー病と闘う企業として、私たちは、lecanemabの良好な第3相臨床試験結果をうれしく思っています。ドナネマブのTRAILBLAZER-ALZ試験に続き、このlecanemabの試験は、初期症状のあるアルツハイマー病患者に対するアミロイド斑の除去の有益性をさらに支持するものと思われます。
これらのデータは、ドナネマブに対する私たちの信頼と、2023年半ばまでに予定されている第3相TRAILBLAZER-ALZ 2試験の結果を補強するものであり、この結果が陽性であれば、従来の承認申請の基礎となるものです。一方、当社は、TRAILBLAZER-ALZのデータに基づき、’23年初頭に加速承認されるようFDAとの協働を続けています。安全で効果的な治療法の入手と利用は、この病気と闘う推定650万人のアメリカ人と全世界3500万人の人々およびその愛する人々への壊滅的な影響を遅らせるために重要なことです。これらの治療法を必要としている患者さんにお届けするために、これから大変な努力が必要であることを認識していますが、アルツハイマー病のポートフォリオと当社の薬剤が患者さんにもたらす潜在的な影響について、私たちは興奮し、自信を持っています」と述べています。
そこで当社は、当社の次世代抗アミロイド抗体であるRemternetugの第3相プログラムの最初の試験であるTRAILRUNNER-ALZを開始しました。Remternetugは、アミロイドプラークを深くかつ迅速にクリアランスすることを実証しており、患者さんへの柔軟な投与レジメンを検討する機会を提供します。最後に、早期アルツハイマー病の患者さんを対象に、ドナネマブとaducanumabを比較したTRAILBLAZER-ALZ 4では、共同主要評価項目であるアミロイド低下において期待通りの結果が得られ、これまでのドナネマブの試験と一貫した安全性プロファイルが得られました。本試験では、ドナネマブ投与群におけるARIA-Eの発現率は21.1%であり、ドナネマブ投与患者の2.8%が症候性ARIA-Eを示したことから、プラーク除去率がARIA発現率と直接関連しない可能性が示唆されました。
アミロイドプラークの除去の程度と血漿中ホスホタウの関係、X線写真の面積など、詳細な結果は11月下旬に開催されるCTAD会議で発表する予定です。本日の市場の大半は後期段階の資産に集中していますが、スライドに示すように、当社の初期段階のポートフォリオにも多くの開発品があることにお気づきでしょう。パイプライン全体では、第3四半期もリリーにとって生産的な四半期となりました。それでは、最後にデイブからご挨拶をお願いします。
デイブ・リックス — 会長兼最高経営責任者
ありがとう、ダン。質疑応答に入る前に、第3四半期の進捗を簡単に総括させていただきます。Mounjaroの米国での好調な発売をはじめ、最近発売した医薬品が引き続き伸びています。
同時に、パイプラインの進展も継続しており、来年末までに4つの新薬の上市に向けて前進するとともに、初期段階のパイプラインや探索能力に対する社内外からの投資も行っています。このような進捗により、当社は長期的な成長の見通しを確信しています。それでは、Q&Aの司会をジョーにお願いします。
ジョー・フレッチャー — シニア・ヴァイス・プレジデント、インベスター・リレーションズ
ありがとう、デイブ [ロイス、Q&Aセッションの指示をお願いします。
質疑応答
オペレーター
ありがとうございます。[オペレーターの指示】最初の質問はJ.P.モルガンのクリス・ショットからです。どうぞよろしくお願いします。
クリス・ショット — JPモルガン・チェース・アンド・カンパニー — アナリスト
素晴らしい。ご質問をありがとうございます。ムンジェロについて、2つだけ質問させてください。1つ目は、これから考えるべきグロス・ネットのトレンドについてです。
現時点では45%のアクセスについてお話されていると思います。2023年初頭を見据えた場合のトレンドと、現在のTrulicityと同様のアクセスが可能になるのはいつ頃だとお考えですか?それから、Mounjaroの2つ目の質問は、これまで非常に優れた上市実績をあげていることから、製造能力についてです。23年末までに生産能力を倍増させることが可能なようですね。より大局的な質問ですが、現在から追加設備が稼働するまでの間に、Mounjaroの取り込みを制限するような生産能力の問題はないのでしょうか?
ジョー・フレッチャー — 投資家向け広報担当上級副社長
ありがとう、クリス。最初の質問であるグロス・トゥ・ネットのトレンドとアクセス、および製造能力に関するコメントは、マイクにお願いしたいと思います。マイク?
マイク・メイソン — リリー・ダイアベテス社 社長
わかりました。クリスさん、質問をありがとうございました。感謝します。発売前にご案内したように、私たちはより多くの収益を見るように勧めました。
これは、純売上高よりも業績の良い指標となるものでした。私たちは、Mounjaroの長期的な価値を生み出すことに焦点を当てた、2つの決定を行いました。まず、2型糖尿病の患者さんが保険診療を受けられるようになるまで、25ドルの低額な自己負担で治療を受けられるようにするブリッジング・プログラムを導入することを決定しました。私たちは、Mounjaroへの幅広いアクセスを構築することに自信を持っていましたし、今も自信を持っています。
しかし、私たちは、アクセスを獲得するために、規律正しく、忍耐強く行動できるようなブリッジング・プログラムを用意したいと考えました。短期的ではなく、長期的な視野で取り組むことを確認したかったのです。短期的な視点にこだわりすぎると、早くアクセスを獲得しようとするあまり、正しい価格決定ができなくなります。そこで、ブリッジング・プログラムと規律ある交渉のアプローチを組み合わせたものが最適だと考えたのです。
そのため、ブリッジング・プログラムと規律ある交渉のアプローチを組み合わせたものが最適だと考え、この方法を採用し、発売後もそれを忠実に守っています。従って、ペイヤーアクセスの獲得に伴い、正味価格が上昇することが予想されます。第3四半期では、民間およびパートDの保険に加入している人のうち、以前はマウンジャロにアクセスできた人は22%でした。それが10月1日現在、45%に跳ね上がっています。
今後も、適切な価格帯で最高のアクセスが得られるよう、統制のとれた穏健なアプローチをとっていく予定です。そして、私たちは、今後の成長と幅広いアクセスを実現することに、大きな自信を持っています。また、2型糖尿病の患者さんに確実に使用していただけるよう、ブリッジングプログラムの調整も行っており、これは新規導入量に影響しますが、純売上高には影響すると思われます。そのため、今後数四半期にわたり、Mounjaroの純価格が上昇するものと思われます。
供給面では、上市以来、当社のサプライチェーンは非常にうまく機能しています。現在、新しい製造設備を立ち上げる一方で、現在の設備に対する生産供給を最大化するための措置をとっています。米国でのMounjaroの発売は、前例がなく、患者さんの満足度が非常に高く、目に見える効果があるため、患者さんや2型糖尿病コミュニティとの会話が弾み、Mounjaroに対する2型糖尿病委員会、当社のコミュニティへの関心も高まっています。
しかし、競合他社のGLP供給が不透明であることや、Mounjaroの患者さんの処方放棄率、長期服用アドヒアランス、用量漸増率が定常状態に至っていないことなどから、ダイナミックな状況となっています。したがって、このダイナミックな性質を考慮すると、毎週の生産予測が毎週の需要に完全に一致することはないと考えるのが妥当です。そのため、サプライチェーンの増強に伴い、一部の投与量に関する卸売注文に断続的な遅れが生じる可能性があります。このような事態が発生した場合、当社のチームは、2型糖尿病患者さんへの短期的な影響を回避または最小化するよう努力します。
しかし、一歩下がって長期的な視点で見ると、私たちは素晴らしいポジションにいます。Mounjaroの上市は、患者さんの体験が非常に素晴らしいものであり、製品プロファイルに高い関心を寄せていただいているため、非常に順調に進んでいます。Mounjaroの上市により、市場の大幅な拡大が見込まれ、将来への自信を深めることができました。また、「Mounjaro」の発売前に製造能力の大幅な増強に着手したのは、この製品の可能性を見越した先見性によるものです。
Mounjaroは、長期的に非常に良いポジションにあります。
Joe Fletcher — 投資家向け広報担当上級副社長
ありがとう、マイク。ロイス、次の質問です。
オペレーター
次の質問はモルガン・スタンレーのテレンス・フリンからです。どうぞよろしくお願いします。
Terence Flynn — Morgan Stanley — アナリスト
ご質問をありがとうございます。私からは2つほどフォローアップをさせてください。製造面についてです。
つまり、今年の前半は供給面での課題が予想されるのでしょうか?ノースカロライナをもっと早く取り込むことはできないのでしょうか。年末まで時間があるのは承知していますが、少しでも早くオンライン化するためにできることを教えてください。それから、ブリッジング・プログラムですが、マイク、あなたはそこにいくつかの変更を加えたと言いましたね。2型糖尿病でない患者さんの割合は、フォワードでは異なるかもしれませんね。
また、フォワードでの患者数の変化について、どのように考えればよいでしょうか。
Joe Fletcher — シニア・ヴァイス・プレジデント、インベスター・リレーションズ
ありがとう、テレンス。マイク?
マイク・メイソン — Lilly Diabetes 社長
はい。製造供給については、主要な製造供給者とチームメイトが非常に優れた結果を出しており、当社の製造供給を最大化するためのあらゆる方法を模索し続けていることを強調したいと思います。彼らは、リサーチ・トライアングル・パークの施設をできるだけ早く稼働させるために、総力を挙げて取り組んでいます。そして、その施設が利用可能になり次第、私たちはその供給を十分に活用するつもりです。
ですから、私たちは製造担当者の能力とリーダーシップに自信を持っています。先ほど申し上げたように、私たちはティルゼパチドの長期的なポテンシャルに非常に自信を持っています。ブリッジング・プログラムについては、Mounjaroの適応外使用とその量に関するご質問が多かったと思います。ご存知のように、Mounjaroは米国で2型糖尿病患者を対象に承認されています。
また、すべてのプロモーション活動が承認された添付文書に沿ったものであることを確認するための優れたプロセスを導入しています。私たちは、規律あるオンラベル・プロモーションの実施に満足しています。Mounjaroの上市は、非常に規律正しく、私たちが望むものすべてに沿ったものでした。患者さんや医師の方々の処方体験に励まされ、Mounjaroへの関心が非常に高まっています。
私たちは、患者さんがどのような診断を受けているかを示す完璧なデータを持っているわけではありません。私たちが持っている最高のデータは、Mounjaroを使い始めた人が、以前に糖尿病の薬を飲んでいたかどうかを見ることです。私たちのプロモーションは2型糖尿病のみにフォーカスしているので、大多数の人が2型糖尿病のためにモウンジャロを使用すると予想されますし、実際にそうなっています。第3四半期は週によって変動がありますが、新規に「モウンジャロ」を開始した患者さんの約3分の2は、2型糖尿病の薬歴があることがわかりました。
残りの3分の1は、糖尿病治療に対してナイーブな患者さんで、新たに2型糖尿病と診断された患者さん、あるいはまだ2型糖尿病と診断されていない患者さんのどちらかだと思います。
Joe Fletcher — シニア・ヴァイス・プレジデント、インベスター・リレーションズ
マイク、ありがとうございます。ロイス、次の質問です。
オペレーター
ありがとうございます。次の質問は、エバコアのウマー・ラファトです。どうぞよろしくお願いします。
ウマー・ラファト — エバーコアISI — アナリスト
おはようございます。私の質問を受けてくださってありがとうございます。Mounjaroについて、簡単な質問をいくつかさせてください。A、第3四半期の米国での売上に対する在庫の貢献についてお聞かせください。
A、第3四半期の米国での売上に対する在庫の貢献について教えてください。B、Mounjaroの売上高と純額、1処方あたりのドルについて、TRULICITYの発売当初の業績と比較してみたいのですが。その結果、Rx当たりの売上はTRULICITYの方が数段高くなりました。患者さんへのサポートの種類や程度について、何か具体的な違いがあればお聞かせください。
Trulicityの発売初期とMounjaroで行っていることを比較すると、明らかにTrulicityの発売初期を大きく上回るボリュームがあります。ありがとうございました。
Joe Fletcher — シニア・ヴァイス・プレジデント、インベスター・リレーションズ
ありがとう、ウマー。それでは、マイク、2つの質問にお答えください。1つ目は第2四半期の売上に対する在庫の貢献について、2つ目はグロス・ネットについて、そしてそれがTrulicityで見たものと比べてどうなるのかについてです。
マイク・メイソン — リリー・ダイアベテス社 社長
わかりました。いい質問ですね。第3四半期の売上に対する在庫の寄与は40%でした。しかし、製品が当社の製品に移行した時点で、その製品が薬局で患者さんの需要に応えるために使われるのか、あるいはチャネルで在庫として使われるのかにかかわらず、リベートや割引が発生することに留意しています。
売上総利益率で見ると、Trulicityの上市とMounjaroの上市で大きく変わったのは、Trulicityの上市時にはMounjaroのようなブリッジング・プログラムがなかったということです。
Joe Fletcher — シニア・ヴァイス・プレジデント、インベスター・リレーションズ
ありがとう、マイク。ロイス、次の質問です。
オペレーター
次の質問は、コーウェンのスティーブ・スカラです。どうぞよろしくお願いします。
スティーブ・スカラ — コーウェン・アンド・カンパニー — アナリスト
どうもありがとうございました。リリーは、Tirzepatideの肥満症の申請について、Surmount-2の結果を提出するようFDAが要求していると考えていますが、その理由は、その試験が糖尿病患者を対象とし、肥満を選択せず、Surmount-1よりも小規模であることから特に関連がないと思われるためでしょうか?また、FDAの要求が微妙な値であることを考えると、Surmount-2の中間評価で緩和される可能性はありますか?これが最初の質問です。第二に、なぜリリーは日本におけるMounjaroの共同販促権を販売したのでしょうか。日本はリリーにとって2番目に大きな市場だと思います。Lillyは日本で大きな足跡を残しており、おそらくMounjaroはLillyにとって重要な長期的ドライバーであり、それをたった8600万ドルで売ったのでしょう。
もちろん、リリーは以前にも中国でのシアリスの権利を売却するなどしていますが、それはシアリスが急落していた時期のことで、Mounjaroはあなたの未来なのでしょうか?ありがとうございました。
Joe Fletcher — 投資家向け広報担当上級副社長
スティーブ、ありがとうございます。まず、FDAと肥満症治療薬Tirzepatideの申請に関する質問ですが、これはダンにお願いします。次に、日本での共同研究契約に関するご質問は、イリヤにお願いします。では、ダン?
Dan Skovronsky — チーフサイエンティフィック&メディカルオフィサー
FDAの要求するSurmount-2についての質問、ありがとうございました。まず最初に、データや安全性などに特別な懸念があるのではないかという心配を取り除くことから始めたいと思います。FDAが懸念しているようなことは何もありません。
2つの試験を行うことに関するFDAの議論は、慢性体重管理における適切かつ良好な対照試験に関するFDAガイダンスと一致するように、この適応症では、主要評価項目を体重減少の閾値に関するガイダンスに従って定義し、肥満患者を対象に複数の試験を行うことが必要である、というだけのことだと私は考えています。そのため、2つの試験を実施することが要求されているのです。
Joe Fletcher — シニア・ヴァイス・プレジデント、インベスター・リレーションズ担当
ありがとう、ダン。イリヤさん、日本のティルゼパチドに関する質問をお受けしますか?
イリヤ・ユファ — リリー・インターナショナル社長
はい、スティーブ。質問をありがとうございます。おっしゃるとおり、日本は重要な市場です。ただ、田辺三菱製薬からの売上と支払いとして認識した8600万ドルは、提携のための前払金で、当社の成長ブランドの多くについて日本で行っている提携と同じものです。
TrulicityやEmgalityのように、私たちは日本の企業と戦略的パートナーシップを結び、革新的な治療法の商業化に成功してきました。田辺三菱は糖尿病領域で大きな規模と経験を有しており、今回の提携により、日本におけるティルゼパチドの価値を最大化することができると考えています。そして、田辺三菱製薬は糖尿病領域で大きな規模と経験を有しています。また、Mounjaroの日本での上市と販売については、経済的な負担を軽減するために、経済的な負担を軽減します。
ジョー・フレッチャー — シニア・ヴァイス・プレジデント、インベスター・リレーションズ
ありがとう、イリヤ。ロイス、次の質問です。
オペレーター
次の質問はバンク・オブ・アメリカのジェフ・ミーチャムさんからです。どうぞよろしくお願いします。
Geoff Meacham — Bank of America Merrill Lynch — アナリスト
おはようございます。質問をありがとうございます。マイク、TrulicityからMounjaroへの乗り換え率が低いとのことですが、Trulicityの前四半期のトレンドの要因は何だったのでしょうか?また、今後数年間のカニバリゼーションをどのように見ていますか? 次にダンさんへの質問ですが、ティルゼパチドと肥満について、MMO試験を追加されましたが、お二人が話された以外にも、肥満が関与する適応症はたくさんあり、冠症候群やその他の幅広い循環器系の適応症が思い浮かびます。ティルゼパチドの臨床投資について、今後どのように優先順位をつけていく予定ですか?
Joe Fletcher — 投資家向け広報担当上級副社長
ありがとう、Geoff。それでは、マイクさんから、前期のトレンドと、継続的なスイッチング率に関して期待されること、そしてダンさんから、ティルゼパチドの開発計画の優先順位について伺いたいと思います。マイク?
Mike Mason — Lilly Diabetes 社長
そうですね。インクレチンの新製品への切り替えは、他のインクレチンから発売されるインクレチンへの切り替えが一般的ですが、その割合は時間とともに減少していきます。これは私が予想していることです。真のチャンスは、市場を拡大し、2型糖尿病の治療に積極的に取り組む前に、それを確認することです。
Joe Fletcher — シニア・ヴァイス・プレジデント、インベスター・リレーションズ
ありがとう、マイク。マイク、ありがとう。
Dan Skovronsky — 最高科学・医学責任者
Geoff、Tirzepatideの将来の適応症についてのご質問ありがとうございます。私たちが検討できることはたくさんあります。ご指摘のように、ティルゼパチドで可能になると思われる減量と正常な代謝の回復は、多くの代謝性疾患や肥満関連疾患に恩恵をもたらすと思われます。では、いつ、どのような治療を行うか、どのように選択すればよいのでしょうか。
当初は、ティルゼパチドのような薬剤で体重を減らすと、下流で健康上の利益が得られることを示すデータ群を作ろうという考えでした。MMOの研究はそのためのものです。また、心不全や睡眠時無呼吸症候群の試験も進行中です。さらに、肥満の危険性、減量と正常な代謝の回復の利点に関する医学的な理解を深めるために、どのような研究を行えばよいかを考えています。
この患者層はどのくらいか、次の患者層はどのくらいかということよりも、その患者層のほとんどすべてが、すでに基礎疾患として肥満を抱えていることに注目し、先ほどコメントしたように、来年には肥満が指摘されるだろうと考えているのです。最後に、もう1つ考えておきたいのは、私たちは肥満との闘いを会社の長期的な目標として捉えているということです。ですから、何世代にもわたる薬剤の開発が期待されます。そして、減量に関する医学的な理解に貢献する機会がたくさんあるはずです。
ジョー・フレッチャー — シニア・ヴァイス・プレジデント、インベスター・リレーションズ
ありがとう、ダン。ロイス、次の質問です。
オペレーター
次の質問は、Wells FargoのMohit Bansalです。どうぞよろしくお願いします。
Mohit Bansal — Wells Fargo Securities — アナリスト
私の質問を受けてくださってありがとうございます。肥満のMounjaroの成長について、1つだけ質問させてください。1億人の患者のうち、糖尿病ではなく肥満の患者についてお聞きしたいのですが。一次予防についてお話されているようですね。
しかし、現在の臨床試験を見ると、それらはどちらかというと二次予防的な設定になっています。そこで質問ですが、現時点で可能な限り幅広い肥満患者を対象とした一次予防の試験を行うことが、どれほど重要なのでしょうか?ありがとうございました。
Joe Fletcher — シニア・バイス・プレジデント、インベスター・リレーションズ
Mohitさん、ご質問ありがとうございました。少し遠まわしな言い方でしたね。肥満の患者層とその機会を最大化する方法について、大筋は理解できたと思います。マイク、いかがでしょうか?
Mike Mason — Lilly Diabetes社長
ええ、喜んでお答えしますよ。実は、肥満症については、一般的に製品に起こることと逆行するようなところがあります。通常、製品を発売すると、患者さんのセグメンテーションが決まっていて、それを追加適応症で説明しようとします。
実際、肥満症では、BMI27で危険因子を持つ人、あるいはBMI30以上の人という幅広い適応症があり、これは米国をはじめ世界的に見ても膨大な数の患者さんがいます。ですから、私たちの試験の目的は、必ずしも患者数を増やすことではなく、肥満を積極的に治療することが健康状態を改善することを実証し、医師や支払者がこの製品にアクセスできるようにすることなのです。
Joe Fletcher — シニア・ヴァイス・プレジデント、インベスター・リレーションズ
マイク、ありがとうございました。ロイス、次の質問です。
オペレーター
次の質問はグッゲンハイムのシェイマス・フェルナンデスからです。どうぞよろしくお願いします。
Seamus Fernandez — Guggenheim Partners — アナリスト
素晴らしい。質問をありがとうございます。早速ですが、2つほど質問させてください。ノースカロライナ工場の製造能力拡大についてですが、原薬と実際のペンと充填仕上げの製造という観点から、そこでの製造の潜在的拡大について最新情報を教えてください。私の理解では、ボトルネックになりそうなのは、むしろペンの製造に関連するものだと思います。
また、これは主にTrulicityのペンであり、TrulicityのペンはTrulicityと同様に貴社の生物学的製剤のほとんどすべての製造拠点となる予定であると私は理解しています。この点についての理解を深めたいと思います。次に、インスリンについてです。インスリンの多くは、実際にインスリンを提供するためにメディケイド費用を支払うことになるため、ペニールールの変更に関して、リリーや競合のノボがどのように対処するのか、多くの疑問があります。
リリーがどのようにその結果を管理しようとしているのか、特に、業界にとって乱暴に不公平に思えるので、理解を深めたいのです。
Joe Fletcher — シニア・ヴァイス・プレジデント、インベスター・リレーションズ
ありがとう、シェーマス。最初の質問は、ノースカロライナの製造施設のダイナミクスについて、デイブに譲りたいと思います。デイブは、MCAPのダイナミクスについて述べているのだと思いますが、インスリンについてもコメントをお願いします。
Dave Ricks — 会長兼最高経営責任者
そうですね。もし私が間違っていたら、Mikeに言ってください。キャパシティの話に戻りますが、私たちは今日、この件に関していくつかのコメントを発表しました。この四半期には、国際的にTrulicityの需要を減速させる措置をとりました。主に競合他社による制約が原因で、国際的に需要がTrulicityにシフトしています。
国内でも同じようなことが起これば、もちろんそれは — 公正なバランスを保つために、私たちも管理しなければならない需要の増加になると考えています。しかし、私たちは今、計画を上回る生産を行っています。それは今後も続くと見ています。次に生産能力が上がるのは、ノースカロライナで、来年末の予定です。
ただ、ノースカロライナ州には、実は2つのサイトがあるんです。1つは2020年に発表したもので、もう1つはシャーロット近郊のコンカーにあるものです。この2つ目の施設も、24年にある程度の生産能力を確保し、25年にはより本格的に稼働させる予定です。ノースカロライナ州では、TrulicityやMounjaroに使用されている親充填と薬剤仕上げ工程と呼ばれる装置に重点を置いています。
私たちはプラットフォーム・アプローチをとっています。この装置は、リリーの他の生物製剤にも使用されています。そして、需要と供給をより俊敏にマッチさせる柔軟性を与えてくれるのです。先ほどMikeのコメントが的確でしたが、90日以内では、すべての需要の偏りを生産するすべてのSKUに完全に一致させることはできないのです。
しかし、そのおかげで、機動性が大幅に向上しました。ノースカロライナ州の2つの工場は、Anatが言ったように、非常に大きな工場です。1つ目の拠点が稼働すれば、グローバルでの生産能力は文字通り2倍になり、2つ目の拠点も同じような規模になります。ですから、私たちは大規模な設備投資を決定しましたし、Mounjaroが早くから好調であったことから、この設備はかなり充実しているように見えます。
これらはAPI側について述べたものではありません。APIは別のサプライチェーンです。私たちは、APIの生産能力を拡大するための措置もとっています。現在ボトルネックになっているのはペプチド合成プロセスではなく、今後もボトルネックになることはないと考えています。
もちろん、これらすべてにまつわる大きな注意点は、もちろん、物事がうまくいかないこともあり得るということです。新しい施設を予定通りに稼働させるためには、規制当局の承認が必要ですが、これが現在の見通しです。マイクが言ったように、長期的にはTrulicityとMounjaroを大量に供給することができると確信しています。しかし、こうしたステップアップには少し時間がかかります。
競合他社の供給が滞れば、当社の需要対応能力が問われることになります。これが今日の主なメッセージだと思います。MCAPについては、おっしゃるとおり、24年1月から、CPIペナルティによって100%リベートを超える医薬品に対するメディケイドプログラムへの支払いまたはリベートの上限が撤廃され、そのような状況で当社の製品を使用する場合は、州に対して支払いを行うことが義務づけられる予定です。その対応策を策定中ではありますが、まだ発表していません。
もちろん、一番良いのは新しいものを発明し続けることで、その計算をリセットすることです。ご存知のように、週1回投与型インスリンの第3相プログラムがあり、グルコースセンシング型インスリンの取り組みも進んでいます。また、コネクテッド・ケア(Connected Care)についても、エキサイティングな新認可を取得しました。これらの取り組みはすべて、23年末から24年初めにかけてのイベントを通じて、戦術的に管理する長期的なアプローチであると私は考えています。
Joe Fletcher — シニア・ヴァイス・プレジデント、インベスター・リレーションズ
シェーマス、ご質問ありがとうございました。ロイス、次の質問です。
オペレーター
次の質問は、ゴールドマン・サックスのクリス・シブタニさんからです。どうぞよろしくお願いします。
クリス・シブタニ — ゴールドマン・サックス — アナリスト
はい、ありがとうございます。質問が2つあります。1つは、ティルゼパチドの肥満の機会について、そしてそこでの規制要件についてです。
サーマウント3および4は、来年の前半に完了する予定だと思います。これらの試験からのデータが要求されない、あるいはFDAに提出する予定がないという点で、はっきりさせておくべきでしょうか。また、仮に提出する場合、そのことが承認・審査のタイムラインに影響を与える可能性はありますか?次に、SABCSで発表されるVerzenioのデータを強調されていました。アジュバント転移性スプリットに関して、どのような影響があるとお考えか、ご説明いただけますか。また、そのデータを見たときに、収益の観点からVerzenioの軌道にどのような影響を及ぼす可能性があるかという点について教えてください。
Joe Fletcher — シニア・ヴァイス・プレジデント、インベスター・リレーションズ
ありがとう、クリス。はい。Tirzepatideの肥満と3、4に関する規制要件についての最初の質問はダンに、そしてVerzenio San Antonio Breast Conferenceのプレビューについてはジェイクにお願いしたいと思います。
Dan Skovronsky — チーフサイエンティフィック&メディカルオフィサー
サーマウント-1とサーマウント-2に基づいて申請するというのが我々の理解で、サーマウント-3と4は必要ないと考えています。したがって、これらの試験結果によるタイムラインへの影響はありません。
Joe Fletcher — シニア・ヴァイス・プレジデント、インベスター・リレーションズ
Jakeさん、Verzenioについて飛び入り参加しませんか?
Jake Van Naarden — Lilly社Loxo Oncologyの最高経営責任者兼Lilly Oncology社長
ダンが準備発言で述べたように、私たちはMonarchの中間解析を事前に計画的に行いました。もちろん、IDFS、DRFS、全生存期間というすべてのエンドポイントについて調べました。
San Antonioでは、それらを発表する予定です。ITT集団のコホート1でも、現在適応があるものでも、試験全体を通して得られた結果には本当に満足しています。ここで考えるべきは2つの要素だと思います。1つは、フォローアップが進むにつれて、データがどのように進化し続けるか?もうひとつは、新しい解析結果が、時間とともに適応症を拡大する可能性にどのように関係してくるかということです。
もちろん、データそのものの評価には慎重でありたいのですが、12月のデータを見ながら考えるべきは、この2つの質問だと考えています。
Joe Fletcher — シニア・ヴァイス・プレジデント、インベスター・リレーションズ
ジェイク、クリス、ありがとうございました。ロイス、次の質問です。
オペレーター
次の質問はUBSのコリン・ブリストウからです。どうぞよろしくお願いします。
コリン・ブリストウ — UBS — アナリスト
おはようございます、そして四半期おめでとうございます。私のほうから2つ、まず肥満について。アムジェンの次期フェーズ3データについてかなり議論されています。
GIPアゴニズムとアンタゴニズムについてお考えをお聞かせください。また、開発面では、GGGとMascutideのアップデートがいつになるのか、教えてください。それから、アルツハイマー病に関しては、ドナネマブについて、アミロイド陰性化を達成した時点で投与を中止するという、個別の投与戦略を追求するという決断は、何か意味があったのでしょうか?その際、抗薬物抗体に関係する部分はありましたか?再投与や維持投与が実際に有益であることを示唆するデータがあることから、このことについて考えているところです。
Joe Fletcher — 投資家向け広報担当上級副社長
両方の質問について、ダンに伺います。1つ目は肥満に関するアムジェンのデータ、2つ目はアルツハイマーと抗薬物抗体に関するバラバラの投与に関するものです。
ダン・スコヴロンスキー — チーフサイエンティフィック&メディカルオフィサー
まず、肥満についてですが、一般的に、私たちの戦略は、食べ物に対する体の反応を模倣することです。インクレチンは、食事に反応して消化管から分泌されるホルモンで、満腹感やカロリー消費量の増加、食事量の減少につながります。GIDは主要なインクレチンの一つです。
アンタゴニズムが、ヒトで通常見られるアクレチンの生物学的効果とは異なる驚くべき効果をもたらすかどうかについては、アムジェン社のデータを待つしかないでしょう。GGGとBCGは、私たちの次世代インクレチンで、開発がさらに進んでいると思います。以前、私たちは、今年中に社内のフェーズ2データを取得し、そのデータをもとにフェーズ3に進むかどうかを決定する予定であるとお伝えしました。その場合、マスタチドのデータを待つことになるかもしれません。
この考え方は一貫しており、今年中に実施する予定です。プラークがはっきりしたら、プラーク消去抗体の投与をやめてもいいという、私たちが先駆的に提唱してきた考え方についてです。これは生物学的な理解に基づいており、抗薬物抗体とは何の関係もありません。しかし、私たちは、脳内の病気が進行中であるにもかかわらず、薬を飲み続けなくてもよいというのは、患者さんにとって有益なことだと考えています。
ドナネマブ、レムテルネグ、プラークに特異的な抗体は、プラークがなくなると、抗体が何かをしてくれるようになるので、かなり特殊なアイデアだと思います。私たちが公表しているデータによると、治療をやめた患者さんでは、有害なバイオマーカーが回復することはないそうです。今のところ、まだ初期段階ですが、手元にあるデータは、適切な投薬の中止をサポートしています。TRAILBLAZER-2では、この仮説を確認することになるでしょう。
Colin Bristow — UBS — アナリスト
素晴らしい。ありがとうございます。
Joe Fletcher — シニア・ヴァイス・プレジデント、インベスター・リレーションズ
コリンさん、ご質問ありがとうございました。ロイス、次の質問です。
オペレーター
次の質問は、SVB証券のデービッド・ライジンガーです。どうぞよろしくお願いします。
David Risinger — SVB Securities — アナリスト
まず、第3四半期に米国で22%のカバレッジがありましたが、それが純収益に十分に反映されませんでしたね。その理由について、もう少し詳しく教えてください。また、10月1日時点のカバレッジ45%という数字について、どのように考えるべきかをよりよく理解するのに役立つと思います。次に、米国での売上見通しについてです。
第2に、米国外の販売見通しについてですが、これはもうお聞きになったかもしれませんが、第4四半期の三菱自動車向けの販売について、前四半期比でどう考えるべきかを教えてください。また、需要が生産能力を上回るリスクがある中で、米国外での展開計画をどのように考えるべきでしょうか。もう1つ、最初の質問の米国での販売に関連することですが、簡単にご説明します。
売上の40%が在庫品であるというコメントがありましたが、それが米国でのコメントなのかどうかが明確ではありませんでした。そこで、最初の質問にお答えいただく際に、その点を明らかにしていただければと思います。
ジョー・フレッチャー — シニア・ヴァイス・プレジデント、インベスター・リレーションズ
ご質問をありがとうございます。最初の質問については、マイクにカバレッジについて少し話してもらうことにします。おそらく、あなたがおっしゃりたいのは、コーペイカードのことだと思います。それから2つ目は、イリヤからOUSの売上見通しとダイナミクス、タイミングについてです。
それではマイクさん、よろしくお願いします。
Mike Mason — Lilly Diabetes社長
わかりました。David、ご質問ありがとうございます。そうですね、チャネルからのコンプのパーセンテージは、米国の数字です。
当社のデータで、セービングカードを通じて支払われたものと、カバーされたスクリプトの割合を見ると、発売以来、その割合は当社のアクセス割合とほぼ一致しています。ですから、ブリッジング・プログラムを利用した場合と支払った場合の割合を示す最も良い指標は、このカードであると言えるでしょう。
Joe Fletcher — シニア・ヴァイス・プレジデント、インベスター・リレーションズ担当
マイク、ありがとうございます。イリヤ、OUSについて教えてください。
イリヤ・ユファ — リリー・インターナショナル社長
そうですね。まず、田辺三菱製薬と契約一時金の動きについてです。基本的に、経済性は契約一時金で、将来の経済性は、実際に日本市場でMounjaroを商品化し、販売を開始したときになります。つまり、一回限りの契約一時金です。
このように、将来のエコノミクスを考えています。米国以外でのMounjaroの商業化という点では、私たちにとって重要なことの1つは、市場に参入するたびに、どの市場でも2型患者さんにMounjaroを適切に供給できることを確認することだと思います。そして、それを評価しながら、アクセスを構築していきます。ご存知のように、米国外のほとんどの市場では、承認取得から患者さんへの償還までのタイムラグがあり、時間がかかります。
もちろん、市場に参入する際には、十分な供給量を確保できるよう監視していきます。
Joe Fletcher — 投資家向け広報担当上級副社長
デイブ、ご質問ありがとうございました。ロイス、次の質問です。
オペレーター
次の質問はカンターのルイーズ・チェンからです。どうぞよろしくお願いします。
Louise Chen — Cantor Fitzgerald — アナリスト
私の質問にお答えいただき、ありがとうございます。最初の質問は、すべてのGLP-1および注射剤の市場は、時間とともにどのように変化していくと思われますか?次に、Novo SELECT試験の結果が良好であれば、支払者にこの機会を納得させるに十分であるとお考えですか?それとも、御社のMMOのようなより広範な試験を探す必要があるとお考えですか?また、以前におっしゃったことがあるかどうかわかりませんが、Surmount-MMOのデータには中間評価があるのでしょうか?
デイブ・リックス — 会長兼最高経営責任者
ありがとう、ルイーズ。マイク、あなたが両方を担当してください。まず、経口グリプスの市場について、次にSELECT試験のポジティブな見通しについてです。
Mike Mason — Lilly Diabetes社長
わかりました。経口GLPの市場についてですが、私たちの市場調査では、消費者は2型糖尿病と肥満の両方において、経口製品に非常に関心を持っています。ですから、経口抗肥満薬の見込みは非常に魅力的です。ですから、私たちはこの機会を大いに期待していますし、NPAプログラムにも期待しています。
CVポジティブ試験についてですが、もしノボがセマグルチドでポジティブな結果を得ることができれば、私にとっては、このクラスの製品のメリットを示す好機となります。私たちの試験であれ、ノボの試験であれ、追加的なベネフィットが示されれば、このクラスの製品に貢献し、より多くの支払者や医療従事者がこの製品に関心を持つきっかけになると思います。ですから、彼らの試験は、医療専門家や支払者に良い情報とデータを提供すると思います。また、私たちの試験は少し異なっており、もう少し広い範囲で実施されると思いますが、これもまた拡大すると思います。
ですから、私たちの試験、Surmount-MMO試験とSELECTを比較するのではなく、より多くの新しい情報が、このクラスや医療従事者にとって良いものになると考えています。私たちは、今日よりもずっと積極的に肥満を治療すべきなのです。これらの試験は、その必要性を示してくれると思います。
デイブ・リックス — 会長兼最高経営責任者
多くのアナリストと話す中で、肥満症に対する幅広い商業的アクセスの引き金となる1つの事象に焦点を当てたいと考えているようです。すでに、慢性的な体重管理や肥満に対する医薬品を償還している民間支払機関があります。しかし、その数はごくわずかです。この10年の間にデータが蓄積されれば、高血圧の治療費が支払われるのと同じように、それが標準になると考えています。
もちろん、大きな動きはTROAや米国での政府保障、あるいは米国での同様の取り組みに関連するものでしょうが、これらはよりバイナリーなものになるでしょう。むしろ、慢性体重管理の健康上の利点を証明するためのリリーの努力と他の企業の努力によって、今後何年にもわたって商業的アクセスが徐々に開かれていくという、時間をかけたより蓄積的な効果について考えることを投資家に勧めたいと思います。
Joe Fletcher — シニア・ヴァイス・プレジデント、インベスター・リレーションズ
ロイス、次の質問です。
オペレーター
次の質問はシティのアンドリュー・ボームさんからです。どうぞよろしくお願いします。
アンドリュー・バウム — シティ — アナリスト
いくつか質問をお願いします。まずRemternetugについてですが、臨床試験のタイムラインについて、この薬はロシュの皮下注射の導入から1年ほどで、加速承認により早ければ25年に上市される可能性があります。アベタのデータが進化することで、既存のNCDが削除され、効果的に競争できるようになると予想していますか?それが最初の質問です。もちろん、その時点ではアベータ低下作用のデータしかありませんが、皮下投与の可能性もあるのでしょうか。2つ目の質問ですが、経口GLP-1製剤に話を戻すと、糖尿病と肥満の両方のフェーズ2試験がまもなくアンブラインドされますね。
この市場の商業的な可能性をどのように見ているか教えてください。DPP4の市場規模は約130億ドルで、それに加えて[Inaudible]が何をやっているのかが気になります。薬物相互作用を解決したら、あるいは解決できたとしたら、それが今後、Mounjaro社に依存しない収益拡大の非常に大きな要因となる可能性はないのでしょうか?
Joe Fletcher — シニア・ヴァイス・プレジデント、インベスター・リレーションズ
アンドリュー、ご質問ありがとうございます。最初のRemternetugとタイムラインについては、NCD除去のダイナミクスと同様に、Anneにコメントしてもらいたいと思います。次に、経口剤Glipsの商業的可能性についてですが、これはマイクにお願いします。
アン・ホワイト — リリー・ニューロサイエンス社 社長
Remternetugに関するご質問をありがとうございました。明らかに、私たちは第3相プログラムを開始したことに興奮しています。ご指摘の通り、アミロイド低下作用を評価する最初の試験を開始しました。ドナネマブで行ったような臨床的なエンドポイントを検討する、より広範な第3相プログラムも開始していますが、次世代であるRemternetugでこれまで見てきたことに興奮しています。
ドナネマブの魅力的なデータに基づいて、ADプラットフォームへの投資を今後も続けていくことになるでしょう。また、Remternetugは、患者さんにとって利便性の高い剤形であると思います。NCDに関するご質問ですが、CMSでは、ドナネマブのフェーズ2データで、プラークの除去とともに臨床的有用性が明確に示されたことを期待しています。また、大規模な第3相試験であるlecanemabのデータも、臨床的有用性を示しています。
確かに、私たちはCMSがこの決定を再考する時期に来ていると考えています。ですから、確かに、私たちはRemternetugが読み上げられる前にこれが解決されることを望んでいます。明らかに、しかし、タイムラインは、明確ではありません。ですから、私たちがすること、そして、私たちが再考を要求するフェーズ3のデータを得るとすぐに同じことをすると確信していますし、今日示された証拠をもとに前進することで、CMSがアルツハイマー病患者がこれらの薬を手に入れるのを妨げ続ける理由を見いだすことはできません。
これまで述べてきたように、CDはこの病気の患者さんに提供するには非常に制限の多い方法であり、アルツハイマー病のケアで見られるような格差にもつながると考えています。ですから、Remternetugを患者さんに提供できるようになるまでに、この問題が解決されることを願っています。
Joe Fletcher — シニア・ヴァイス・プレジデント、インベスター・リレーションズ
ありがとうございます。マイク、経口GLPの商業的機会について、何か付け加えることはありますか?
Mike Mason — Lilly Diabetes社長
アンドリュー、あなたの考えは正しいと思います。Rybelsusが発売されたとき、私たちはこの製品が注射剤市場に影響を与えるのではなく、このクラスを成長させると予想していましたが、まさにそのとおりになりました。まさにその通りでした。そしてMounjaroが発売されると、Mounjaroの需要のうち、Rybelsusや経口GLPから来るものは1%に過ぎないと見ています。
ですから、おっしゃるとおりだと思います。追加的対魅力的だと思いますし、私たちはこの機会に非常に満足しています。リベルスには水や食物との相互作用があり、投与量に制限があるため、注意深く観察しないと製品の有効性に影響を与える可能性があります。また、リベルス経口剤と注射剤の有効性には差があるため、経口市場において鍵となるのは、リベルスです。ですから、経口剤の有効性が高まるにつれて、食べ物や水との相互作用がない代替品を手に入れることができれば、市場の可能性はさらに高まると考えています。
ジョー・フレッチャー — シニア・ヴァイス・プレジデント、インベスター・リレーションズ
アンドリュー、ご質問ありがとうございました。ロイス、次の質問です。
オペレーター
次の質問はBMOキャピタル・マーケッツのエヴァン・セイガーマンさんからです。どうぞよろしくお願いします。
エヴァン・セイガーマン — BMOキャピタル・マーケッツ — アナリスト
Mounjaro Manzaroについて1つ、Mounjaroコールのようですね。アウトカムトライアルについてですが、プライマリーエンドポイントで見たい相対リスクの減少のようなものについてコメントいただけますか?もし、コメントできないのであれば、ペイヤーアクセスを得るために必要なアウトカムについて、もう少し詳しく教えてください。2つ目の質問は、Clarity IDについてです。この試験に関する前向きなコメントには感謝しています。しかし、これらのデータによって、有効性のハードルが上がったとお考えですか?また、エンドポイントがFDAの完全承認やCMSや他の支払者による適用の可能性を得るのに十分であると考える理由を教えていただけませんか。
Joe Fletcher — シニア・ヴァイス・プレジデント、インベスター・リレーションズ
エヴァン、ありがとう。Mounjaroに関する最初の質問、アウトカムトライアルとペイヤーアクセスに必要なものについては、マイクに引き継ぎます。そして、Clarity ADについては、アンに引き継ぎます。
Mike Mason — Lilly Diabetes社長
わかりました。肥満症へのアクセスについて、また、それが時間とともにどのように発展していくかについて、もう1度お話ししたいと思います。Daveは、エビデンスの着実な積み重ねが必要で、すべての支払者、すべての雇用者が独自に決断し、それは時間とともに大きくなると話していたと思います。もうひとつのアプローチとして、私たちはティルゼパチドを、心不全や睡眠時無呼吸症候群など、肥満を抱える人々に対する他の適応症で研究しています。
このような適応症は、すでに民間企業やメディケアパートDによってサポートされています。ですから、私たちは、MMO試験の結果に向けて開発を進めながら、このような適応症で有効性を実証し、適応症を取得すれば、それ自体が、睡眠時無呼吸症候群や心不全を持つ肥満症の人々のための支払いアクセスのサブセットを解放することになると信じています。この2つの出来事は、Tirzepatideのライフサイクルにおいて重要な出来事だと思います。
Joe Fletcher — シニア・ヴァイス・プレジデント、インベスター・リレーションズ
ありがとう、マイク。アンさん?
アン・ホワイト — リリー・ニューロサイエンス社 社長
Clarity ADに関するご質問ありがとうございます。ご質問の件ですが、私たちは、今回のデータが臨床的に意味のあるものであると確信しています。そして明らかに、患者さん、家族、ケアパートナーは、自立した安定性の喪失を遅らせることを高く評価しています。ですから、ADの初期段階で20%から30%病勢を遅らせることができれば、より機能的で障害の少ない段階での時間を増やすことができるはずです。ですから、私たちはこの結果に興奮していますし、この分野では臨床的に意味のあることだと考えています。
ドナネマブについては、これまで述べてきたように、今後が楽しみです。私たちがdonanemabに非常に自信を持っている理由はたくさんあり、それは変わっていません。ドナネマブには、私たちが自信を持っている理由がたくさんありますが、それは今も変わっていません。ですから、ご指摘のようなエンドポイントの選択、患者さんの選択、そして重要なのは、プラーククリアランスの速度と深さなど、私たちの試験で得られたものは、明らかにポジティブな第2相試験と言えるでしょう。ですから、TD2試験で得られる結果には、引き続き大きな自信を持っています。
それから、ご質問の件ですが、これまでにも申し上げてきたように、この領域ではエンドポイントが最も強固であると信じています。TD2については、これまでにも申し上げてきたように、この分野では最も堅牢なエンドポイントだと考えていますし、エンドポイントはややノイズが多いので、正確な数字を指標化することはおそらく最善の策ではないと考えています。しかし、TRAILBLAZER-ALZでは、Idrisのために力を発揮しました。32%の減速が確認され、これは臨床的に意義のあることだと考えています。
そして、イドリスは常に最も真実に近いパフォーマンスを示すと信じています。しかし、十分に大規模な試験であれば、すべての評価項目が同じように推移すると考えています。ですから、私たちはイドリスの選択に引き続き自信を持っています。また、2023年半ばに発表されるTP2測定値についても、引き続き自信を持っています。
Joe Fletcher — 投資家向け広報担当上級副社長
Ivanさん、ご質問ありがとうございました。ロイス、次の質問です。
オペレーター
次の質問は、Wolfe Researchのティム・アンダーソンからです。どうぞよろしくお願いします。
ティム・アンダーソン — ウルフ・リサーチ — アナリスト
ありがとうございます。ちょっとだけアルツハイマーを立たせてください。次に来る大きな読み物、つまりロシュのデータについて、あなたの最新の見解を聞かせてください。率直に言って、この読み出しはlecanemabの下流でも失敗すると予想されますか?そのデータに対して、皆さんはまだ慎重になっているように思えますが、最新の考えはどうでしょうか?2つ目の質問ですが、2023年のpushes and pullsと、ドナネマブについて言及されていません。
2023年にドナネマブが承認される見込みでしょうか?3つ目の質問ですが、ARIA-Eのデータについて、それが重要で臨床的に差別化できるとお考えでしょうか。
Joe Fletcher — シニア・ヴァイス・プレジデント、インベスター・リレーションズ
ありがとう、ティム。2つある質問のうち、もう1つありますね。ロシュについてはアンから、ドナネマブについてはプッシュプルのタイミングについて、そして最後にルカネマブの差別化について、それぞれコメントをいただきたいと思います。まずロシュについて、ダンさんからご意見をお願いします。
Dan Skovronsky — チーフサイエンティフィック&メディカルオフィサー
わかりました。はい。それから、Timの最後の質問はARIAのレートについてだったと思いますが、それについてもお答えしたいと思います。前にも申し上げましたが、アミロイド低下薬の結果を予測するのに役立つ要素がいくつかあります。
私たちの見解では、おそらく最も重要なのはアミロイド低下の度合いで、ドナネマブの結果には本当に満足しています。しかし、レカネマブもおそらくかなり強力なアミロイド低下剤でしょう。この3剤のうち1剤の第3相試験でポジティブな結果が得られれば、他の2剤の成功確率も上がるはずです。しかし、アルツハイマー病は、時に予測困難な研究を伴うリスクの高い分野であることを、私は皆さんにお伝えしておきたいと思います。
だから、私たちは少し慎重になっています。もちろん、私たちはもっとポジティブな研究や、患者さんにとって良いニュースを見たいと思っています。もう1つの質問についてはAnneに譲るとして、私はARIA-Eとlecanemabのデータを取り上げたいと思います。いくつかの重要な理由があって、試験間の比較は少し難しいのですが、CTADでの発表でもっとお話できるかもしれません。
TRAILBLAZERは、ARIAと比較するために2種類の薬剤の試験内比較を行った初めての例です。なぜそれが重要なのでしょうか?2つの異なる試験を見るとき、まず第一に、異なる患者集団が存在します。ARIAの発生率は病期によって異なり、脳の病態が重篤な患者さんほど多いということが、いずれ分かってくると思います。その可能性は高いと思います。
次に、同じ集団であっても、例えば、試験によってARIAの測定方法が大きく異なることがあります。レカネマブは、私たちのようにMRIの撮影回数が多かったり、MRIの撮影時間が早かったりすると、ドナネマブと使用するMRIのタイミングが異なるのだと思います。私たちのようにMRIを多く撮ったり、MRIを早く撮ったりすると、より多くのレントゲン写真上のARIAが見つかる可能性が高くなります。ですから、臨床試験間の比較にはもう一つ注意が必要です。
しかし、私はARIA率を重要視しています。特に、患者によっては深刻な結果をもたらす症候性ARIAです。私たちが注目すべきは、X線画像ARIAではなく、重篤なイベントでしょう。アン?
アン・ホワイト — リリー・ニューロサイエンス社 社長
それからタイミングですが、ダンの話の中で、TRAILBLAZER-ALZ 2のデータリードアウトは23年半ばになると予想されているとありました。ですから、私たちの意図はデータを迅速に提出することであり、FDAによる追加申請の審査がタイムリーに行われることを期待しています。その結果、2024年前半に従来の承認が得られる可能性があります。そして、先ほど申し上げたように、我々は再考を求めることになると思います。
しかし、あなたのコメントにもあるように、加速承認される時期には、本当に限られた人しか承認されないと予想しています。私たちが考えているのは、そのような時間軸です。
Joe Fletcher — シニア・ヴァイス・プレジデント、インベスター・リレーションズ
ティム、ご質問ありがとうございました。あと2つ質問があると思います。
オペレーター
次の質問は、ベレンバーグのケリー・ホルフォードからです。どうぞよろしくお願いします。
ケリー・ホルフォード — ベレンバーグ・キャピタル・マーケッツ —
ありがとうございます。私からは2つ。Surmount-MMOについてですが、SELECT試験で糖尿病に使用された、より伝統的な3つのポイントをベースにしている理由を理解したいのです。この2つのエンドポイントを追加する根拠は何ですか?そして、なぜ負債ではなく、死亡率を描いているのでしょうか。
これらのエンドポイントを含めると、より広範な適格基準によってイベントが促進されるのでしょうか?次に、治療の焦点についての質問です。PTL3は、心血管系疾患のフェーズ2に移行することを決定されました。心疾患は、参加するのに高額なリスクを伴う治療カテゴリーだと思います。フェーズ2が成功したと仮定して、これらのパイプラインや途中の資産を単独で市場に投入することを想定しているのでしょうか?それともパートナーシップを検討する必要があるのでしょうか?
Joe Fletcher — シニア・ヴァイス・プレジデント、インベスター・リレーションズ
ありがとう、ケリー。ありがとうございます。最初の質問はサーマウントMMOのデザインについて、2つ目はAngptl3とASCVDについて、より一般的な質問をお願いします。
Dan Skovronsky — 最高科学・医学責任者
はい、ありがとうございます。ケリーさん、2つとも丁寧な質問ですね。もちろん、薬や糖尿病については、過去にFDAの要求事項のようなものがあり、リスクを取り除くことに人々の関心が向けられていたことはご存じだと思いますが、最終的に私たちは、ある種のCVアウトカムの研究を行いました。そして、最終的には、ある種の薬剤が実際に利益をもたらすことを発見したのです。
つまり、このような患者さんの肥満を解消し、代謝を改善することは、さまざまな利益をもたらす可能性があるということです。そのために、私たちは2つのことを行いました。従来の心血管系のエンドポイントを超えました。これは主に心血管系の薬です。
代謝を改善する薬です。代謝を改善することで、全死因死亡率など、より広い範囲での効果が期待できると考えています。そして次に、より広い範囲の集団に投与して、その集団における効果を示すことができるようにしなければなりません。これが私たちの考えです。
これは、このクラスの薬剤の自然な進化であると思います。ANGPTL3に関しては、フェーズ2について、また、ポジティブな結果が出た場合にどうするかという質問がありました。もちろん、私たちがこうしたフェーズ2試験を行うのは、患者さんにとって有望な薬剤を探すためです。循環器領域では、大規模なフェーズ3試験にはリスクが伴うことがあるというご指摘はごもっともだと思います。
この場合、このメカニズムについて、また、第2相から第3相へ、つまりフェーズ2からフェーズ3へ移行する方法について、それなりの理解が得られています。しかし、それでも私たちが重視しているのは、ここで大きな効果のある薬剤を見つけることです。もし第2相試験で大きな効果が見られれば、第3相試験の心血管系アウトカム試験でポジティブな強いシグナルが予測されますから、まさにそれを実行することになります。リリーが単独で行うのか、それともパートナーとして行うのかという点については、おそらくそのような話をするのは時期尚早でしょう。
Joe Fletcher — シニア・ヴァイス・プレジデント、インベスター・リレーションズ
ありがとう、ケリー。ロイス、最後の質問をお願いします。
オペレーター
トゥルーイスト証券のロビン・カルナウスカスからです。ご質問をどうぞ。
Robyn Karnauskas — Truist Securities — アナリスト
素晴らしい。ありがとうございます。最初の質問は、Mounjaroについてです。この電話会議では、供給と傾向についてお話されたと思います。
しかし、どの用量が最も使用されているかなど、個々の投与量について少しお話いただけますか?また、もし需要予測を上回るような事態が発生した場合、どの用量が最も影響を受ける可能性があるのでしょうか。スイッチングが30%、新規が70%でしたね。低用量が先なのか、中用量が先なのか。次に、アルツハイマー型認知症についてですが、多くの医師が、御社はアベータ型認知症治療薬の中で最も高いシェアを占めていると言っています。先生方の心に響く最も重要なことは何か、少しお話しいただけますか?サブキュですか?頻回投与なのか、保険適用された後の普及速度を考えると、ベネフィットの大きさなのか。
Joe Fletcher — シニア・ヴァイス・プレジデント、インベスター・リレーションズ
ありがとう、ロビン。では、マイク、投与力学に関する質問を担当しますか?それから、ADとマインドシェアに関する質問ですが、これはアンが担当します。マイク?
マイク・メイソン — リリー・ダイアベテス社 社長
はい、喜んでお答えします。実世界での用量漸増は、私たちの臨床試験とは異なると思います。臨床試験では、用量反応が5、10、15とどうなるかをテストする必要がありました。そのため、臨床試験では、迅速な試験と効果を示すために、4週間ごとに投与量を漸増しました。
実際の臨床試験では、2.5から始めて5まで増量していくことが多いようです。2.5ミリグラムから始めて5ミリグラムにすると、2型糖尿病の患者さんにとって非常に有効です。もっと必要であれば、投与量を増やします。4週間後ではなく、3カ月後になるかもしれません。
このような傾向は現在も続いていますが、当社の販売量の大部分は、2.5ミリグラムと5ミリグラムです。先ほどの私のコメントで、特定の用量での不足を読み過ぎないようにしていただきたいと思います。先ほど私が申し上げたのは、さまざまな要素が絡み合っているということです。さまざまな力学があるのです。
SKUの投与量レベルで製造計画を立てるのは、実際に私たちが使う時よりも1~2カ月先でなければなりません。そうすると、その週に市場で必要とされる需要に、すべての用量が完全に一致するでしょうか。そうでない場合もあります。もしそうであれば、1~2回分の投与量がその週の注文に間に合わないかもしれません。
そして、患者さんに影響を与えないように、私たちのチームは非常に緊密に、懸命に働いています。
アン・ホワイト — リリー・ニューロサイエンス社 社長
素晴らしい。マインドシェアについてご意見をいただきありがとうございます。ありがとうございます。そして、私は……その質問をよく考えてみると、それは、私たちがアルツハイマー病の領域に投資してきた数十年の間に築き上げられたものだと思うのです。
私たちは30年以上にわたってこの分野に取り組み、かなりの時間と資源を投入してきました。その結果、まずこの領域で診断法が大きく進化し、タウビッドの発売が実現しました。さらに、来年にはPTAL血液診断薬を発売する予定で、これらの患者さんへのアクセスや診断を改善することができます。このように、適切な患者さんに治療を受けていただくために、私たちのコミットメントを示すことが出発点だと考えています。この診断ができるようになったことが、この分野での臨床試験を成功させるための重要なポイントの1つだと考えています。
長年にわたる学習、これまでの試験から得た知見、そして経験したいくつかの失敗が、TRAILBLAZER-ALZによるこの分野では初めてのポジティブな試験につながり、アミロイド斑を有意かつ迅速に除去することを示しましたし、最も重要なことは、病気の進行を本当に遅らせることを皆さんに示していただいたことです。このようなマインドシェアは、私たちがこの分野で示したコミットメントと、患者さんが本当に診断を受けられるようにするためのコミットメントの上に成り立っているのだと思います。来年の最初の数カ月は、患者さんへのアクセスを確保するために、早期かつ正確な診断ができるよう、多くの時間を費やします。ドナネマブが順調に推移していることに、私たちはとても満足しています。
先ほど申し上げたように、私たちは、TRAILBLAZER-ALZで見たように、プラークの除去がこの疾患の鍵であると信じていますし、Lcanemabの結果はそれを補強するものだと思っています。そして、ドナネマブがそれを実現することが分かっています。CTADでTV4のデータを発表するのを楽しみにしています。TRAILBLAZER-ALZで確認されたことが、TV2でどのように補強され、どのようなデザインで、どのようなパフォーマンスが期待されるかが分かると思います。
しかし、これは、長年にわたってこの分野を支え、投資してきた結果、私たちや他の企業にとってポジティブな試みにつながったのだと思います。ですから、ここにいる多くの科学者にとって、この集大成を見ることはやりがいのあることだと思います。しかし、アルツハイマー病の患者さんにとって本当に意味のある動きが始まる、エキサイティングな時期だと思います。来年には結果が出るでしょうし、来年早々には早期承認が得られると思います。
ありがとうございました。
Joe Fletcher — シニア・ヴァイス・プレジデント、インベスター・リレーションズ
ロビン、ご質問ありがとうございます。ロイスさん?
オペレーター
他にご質問はございませんね。ありがとうございました。
デイブ・リックス — 会長兼最高経営責任者
わかりました。リリーチームの皆さん、ありがとうございました。本日の電話会議にお付き合いいただいた皆様、そして私たちの会社に関心を持っていただいた皆様に感謝いたします。IRチームへのフォローアップをお願いします。
私たちが説明しなかった質問があれば、IRチームにフォローしてください。皆さん、良い一日をお過ごしください。ありがとうございました。
オペレーター
ありがとうございました。皆様、この会議の模様は、本日12時45分から11月8日午前0時まで、リプレイでお楽しみいただけます。AT&Tのリプレイ・システムには、いつでもアクセスすることができます。国際電話からは402-970-0847におかけください。
以上で本日の会議を終了いたします。AT&Tの電話会議をご利用いただき、ありがとうございました。これにて終了とさせていただきます。
以上です。他の翻訳希望やご感想をいただけると嬉しいです。
*誤訳などがあるかもしれませんでの参考程度にしていただき投資は自己判断でお願いします。
ブログ運営の励みになりますので、お手数ですが、応援の1日1クリックをよろしくお願い致します。
↓↓<応援クリックお願いします>


